
【題目】一氧化二氯(Cl2O)是一種常用的氯化劑。常溫下,Cl2O是棕黃色、有刺激性氣味的氣體,熔 點為-120.6°C,沸點為2.0°C,易與水反應生成次氯酸。實驗室欲用氯氣通入含水8%的碳酸鈉固體中 制備并收集少量純凈的Cl2O,請用下列裝置設計實驗并探究相關物質的性質。
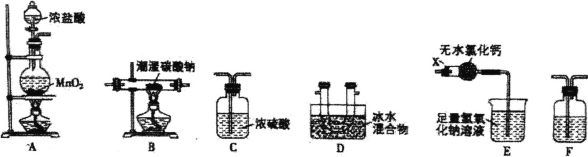
(1)裝置E中儀器X的名稱為 ______。
(2)裝置的連接順序是A __________(每個裝置限用一次)。
(3)裝置F中盛裝試劑的名稱為______,裝置E中無水氯化鈣的作用是 ________.。
(4)裝置B殘留固體中除NaCl外還含有一種酸式鹽M,寫出裝置B中發生反應的化學方程式 _______。
(5)證明殘留固體中含有M的最簡單的實驗方案是: _______。
(6)測定殘留固體中M的質量分數:取mg樣品加適量蒸餾水使之溶解,加入幾滴酚酞,用0.1 mol/L 的鹽酸標準溶液滴定至溶液由紅色變為無色,消耗鹽酸V1mL;再向已變無色的溶液中加入幾滴甲基橙,繼續用該鹽酸滴定至溶液由黃色變橙色,又消耗鹽酸V2 mL.。
①實驗時用到的玻璃儀器有燒杯、膠頭滴管、玻璃棒、____。
②求殘留固體中M的質量分數__________(用含m、V1和![]() 的代數式表示)。
的代數式表示)。
③若用甲基橙作指示劑滴定結束時,滴定管尖頭有氣泡,測定結果將____填“偏高"、“偏低”或“不變”)。
【答案】(球形)干燥管 F、B、C、D、E 飽和食鹽水 防止E中的水進入D中發生反應 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl 取少量樣品于試管中,加熱,將分解產生的氣體通入澄清石灰水,如果變渾濁,就說明有M 錐形瓶、酸式滴定管 ![]() ×100% 偏低
×100% 偏低
【解析】
制取氧化二氯(C12O)的流程為:利用A裝置通過反應MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O制取Cl2,由于濃鹽酸具有揮發性,制取的氯氣中混有HCl,為防止干擾Cl2O的制取,需要先用裝置F除去HCl雜質,再利用裝置B發生反應2Na2CO3+H2O+2Cl2
Mn2++Cl2↑+2H2O制取Cl2,由于濃鹽酸具有揮發性,制取的氯氣中混有HCl,為防止干擾Cl2O的制取,需要先用裝置F除去HCl雜質,再利用裝置B發生反應2Na2CO3+H2O+2Cl2![]() 2NaCl+2NaHCO3+Cl2O制取Cl2O,由于Cl2O易溶于水,同時與水反應生成次氯酸,所以收集前要通過C裝置干燥,再利用裝置D收集Cl2O,并驗證其沸點低、易液化的特點,同時由于氯氣、Cl2O都是大氣污染物,最后要用E裝置進行尾氣處理,據此解答。
2NaCl+2NaHCO3+Cl2O制取Cl2O,由于Cl2O易溶于水,同時與水反應生成次氯酸,所以收集前要通過C裝置干燥,再利用裝置D收集Cl2O,并驗證其沸點低、易液化的特點,同時由于氯氣、Cl2O都是大氣污染物,最后要用E裝置進行尾氣處理,據此解答。
(1)根據裝置圖可知,裝置E中儀器X的名稱為球形干燥管;
(2)利用A裝置制取氯氣,由于濃鹽酸具有揮發性,制取的氯氣中混有HCl,為防止干擾Cl2O的制取,需要先用裝置F除去HCl雜質,再利用裝置B發生反應2Na2CO3+H2O+2Cl2![]() 2NaCl+2NaHCO3+Cl2O制取Cl2O,由于Cl2O易溶于水,同時與水反應生成次氯酸,所以收集前要通過C裝置干燥,再利用裝置D收集Cl2O,并驗證其沸點低、易液化的特點,同時由于氯氣、Cl2O都是大氣污染物,最后要用E裝置進行尾氣處理,則按氣體從左至右流動裝置連接順序是AFBCDE;
2NaCl+2NaHCO3+Cl2O制取Cl2O,由于Cl2O易溶于水,同時與水反應生成次氯酸,所以收集前要通過C裝置干燥,再利用裝置D收集Cl2O,并驗證其沸點低、易液化的特點,同時由于氯氣、Cl2O都是大氣污染物,最后要用E裝置進行尾氣處理,則按氣體從左至右流動裝置連接順序是AFBCDE;
(3)裝置F是除去Cl2中的雜質HCl氣體的,為減少Cl2的溶解消耗,要通過盛有飽和食鹽水的溶液來除去HCl雜質,故裝置F中盛裝試劑的名稱為飽和食鹽水;裝置E中無水氯化鈣的作用是防止E中的水進入D中發生反應;
(4)裝置B殘留固體中除NaCl外還含有一種酸式鹽M,此酸式鹽應為NaHCO3,則裝置B中發生反應的化學方程式為2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(5)NaHCO3不穩定,受熱易分解生成CO2氣體,則證明殘留固體中含有NaHCO3的最簡單的實驗方案是取少量樣品于試管中,加熱,將分解產生的氣體通入澄清石灰水,如果變渾濁,就說明有NaHCO3;
(6)①固體溶解時需要燒杯和玻璃棒,滴加指示劑時需要膠頭滴管,滴定操作時需要酸式滴定管和錐形瓶,則實驗時用到的玻璃儀器除燒杯、膠頭滴管、玻璃棒外,還需要錐形瓶、酸式滴定管;
②加入幾滴酚酞,用0.1 mol/L 的鹽酸標準溶液滴定至溶液由紅色變為無色,此時發生的反應為Na2CO3+HCl=NaHCO3+NaCl;再向已變無色的溶液中加入幾滴甲基橙,繼續用該鹽酸滴定至溶液由黃色變橙色,發生的反應為NaHCO3+HCl=NaCl+H2O+CO2↑;且原溶液中的Na2CO3在滴定時二步操作消耗的鹽酸體積相等,則NaHCO3消耗的鹽酸體積為(V2- V1 )mL,其物質的量為0.1 mol/L×(V2- V1 )×10-3L=(V2- V1 )×10-4mol,則殘留固體中NaHCO3的質量分數為
![]() ×100%;
×100%;
③若用甲基橙作指示劑滴定結束時,滴定管尖頭有氣泡,則讀數偏小,即消耗有鹽酸體積偏小,導致測定結果將偏低。


科目:高中化學 來源: 題型:
【題目】現用Na2SO4固體來配制480mL0.2mol·L-1的Na2SO4溶液。可供選擇的儀器如圖:
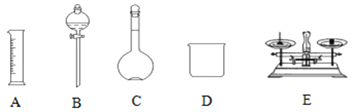
(1)如圖所示的儀器中配制溶液不需要的是__ (填選項),配制上述溶液還需用到的玻璃儀器是___、__ (填儀器名稱)。
(2)使用容量瓶之前必須進行的操作是___。(填選項)
A.檢查氣密性 B.檢查是否漏水 C.烘干
(3)經計算,需Na2SO4的質量為___g。
(4)你選用的容量瓶規格為___mL。
(5)配制溶液時,一般可分為以下幾個步驟:
①稱量 ②計算 ③溶解 ④搖勻 ⑤轉移 ⑥洗滌 ⑦定容
其操作順序:②→__→__→__→__→__→__(填序號)。___
(6)在配制過程中,其他操作都準確,定容時俯視刻度線會使所配溶液濃度__(填“偏高”、“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鈉(Na2S2O4)俗稱保險粉,易被氧氣氧化。利用如圖裝置,在錐形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2時發生反應生成保險粉和一種常見氣體,下列說法錯誤的是
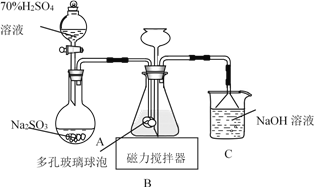
A. 制備保險粉的離子方程式為HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大氣體與溶液的接觸面積,使SO2能被充分吸收
D. 為避免產生的Na2S2O4被O2氧化,使硫酸與亞硫酸鈉先反應,產生的SO2排出裝置中殘留的O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“太陽水”電池裝置如圖所示,該電池由三個電極組成,其中a為TiO2電極,b為Pt電極,c為WO3電極,電解質溶液為pH=3的Li2SO4-H2SO4溶液。鋰離子交換膜將電池分為A、B兩個區,A區與大 氣相通,B區為封閉體系并有N2保護。下列關于該電池的說法錯誤的是( )
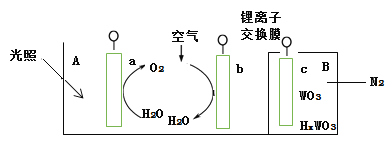
A.若用導線連接a、c,則a為負極,該電極附近pH減小
B.若用導線連接a、c,則c電極的電極反應式為HxWO3 - xe- =WO3 + xH+
C.若用導線先連接a、c,再連接b、c,可實現太陽能向電能轉化
D.若用導線連接b、c, b電極的電極反應式為O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種物質有如圖所示轉化關系,其中X與稀鹽酸不反應:
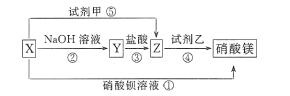
(1)根據上述轉化關系,推斷下列物質的化學式: X_____,Y_____,Z____,試劑甲____,試劑乙____。
(2)寫出上述①~⑤步反應的離子方程式:
①____________________________________________。
②____________________________________________。
③____________________________________________。
④____________________________________________。
⑤____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積不變的密閉容器中存在如下反應:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小組研究了其他條件不變時,改變某一條件對上述反應的影響,下列分析正確的是
3C(g);ΔH<0,某研究小組研究了其他條件不變時,改變某一條件對上述反應的影響,下列分析正確的是
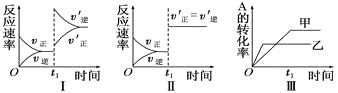
A. 圖Ⅰ表示的是t1時刻增大反應物的濃度對反應速率的影響
B. 圖Ⅱ表示的一定是t1時刻加入催化劑后對反應速率的影響
C. 圖Ⅲ表示的是溫度對化學平衡的影響,且乙的溫度較高
D. 圖Ⅲ表示的是不同催化劑對平衡的影響,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銀鋅電池是一種常見化學電源,其反應原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意圖如圖。下列說法不正確的是:

A. Ag2O電極是正極
B. 電子由Zn電極流出,經過KOH溶液流入Ag2O電極
C. Zn電極的電極反應式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向負極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向X的溶液中,加入Y試劑,產生的沉淀或氣體的量如圖所示,其中與所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積一定的密閉容器中,置入一定量的一氧化氮和足量碳發生化學反應:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡時c (NO)與溫度T的關系如下圖所示,則下列說法正確的是
CO2(g)+N2(g),平衡時c (NO)與溫度T的關系如下圖所示,則下列說法正確的是
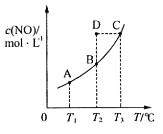
A. 該反應的△H>0
B. 若該反應在T1、T2時的平衡常數分別為K1、K2,則K1<K2
C.在T2時,若反應體系處于狀態D,則此時![]()
D.若狀態B、C、D的壓強分別為PB、PC 、PD ,則 PC=PD>PB
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com