

分析 (1)根據X的特征可知為分液漏斗;將長頸漏斗的下口插入水中,利用氣體熱脹冷縮進行檢驗;
(2)氨氣極易溶于水,防止倒吸;
(3)實驗室中用氯化銨和氫氧化鈣固體制取氧氣;
(4)低于O℃,液體易凍結,反應困難,溫度過高,過氧化氫分解速率加快;
CaCl2與H2O2、NH3、H2O反應生成CaO2•8H2O與NH4Cl;
(5)①140℃時完全脫水,雜質受熱不分解,結合樣品總質量計算出結晶水的總質量、物質的量,從而得出樣品中CaO2•8H2O物質的量,再根據60℃時固體的質量計算出失去結晶水的質量、物質的量,進而計算出CaO2•xH2O中的x;
②根據①計算出的樣品中CaO2的物質的量,根據m=nM計算出其質量,再計算出樣品中CaO2•8H2O的純度.
解答 解:(1)根據X的特征可知X為分液漏斗;將長頸漏斗的下口插入水中用手捂試管在管口有氣泡產生,松手后形成一段穩定的水柱,
故答案為:分液漏斗;將長頸漏斗的下口插入水中用手捂試管在管口有氣泡產生,松手后形成一段穩定的水柱;
(2)A中產生的氨氣極易溶于C中,B裝置可以防倒吸,
故答案為:防倒吸;
(3)實驗室中用氯化銨和氫氧化鈣固體制取氧氣,反應方程式為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)由于低于0℃,液體易凍結,反應困難,而溫度較高,過氧化氫分解速率加快,所以制取CaO2•8H2O一般在0℃~5℃的低溫下進行;
生成CaO2•8H20的化學方程式為:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O,
故答案為:低于0℃,液體易凍結,反應困難,溫度較高,過氧化氫分解速率加快;CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O;
(5)①140℃時完全脫水,雜質受熱不分解,則樣品中CaO2•8H2O含有的結晶水的總質量為:2.76g-1.32g=1.44g,結晶水的物質的量為:$\frac{1.44g}{18g/mol}$=0.08mol,原樣品中含有CaO2•8H2O的物質的量為:$\frac{0.08mol}{8}$=0.01mol,
60℃時固體的質量為1.68g,失去結晶水的質量為:2.76g-1.68g=1.08g,失去結晶水的物質的量為:$\frac{1.08g}{18g/mol}$=0.06mol,故60℃時CaO2•xH2O中x=$\frac{0.08mol-0.6mol}{0.01mol}$=2,
故答案為:2;
②根據①可知CaO2•8H2O的物質的量為0.01mol,則CaO2的物質的量也是0.01mol,其質量為:72g/mol×0.01mol=0.72g,樣品中CaO2的純度為:$\frac{0.72g}{2.76g}$×100%≈26.09%,
故答案為:26.09%.
點評 本題考查實驗方案的設計、物質組成及含量測定計算,題目難度中等,充分考查學生的分析理解能力、知識遷移應用能力.


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:選擇題
| A. | 30g HCHO與過量的新制的氫氧化銅懸濁液反應轉移了4NA個電子 | |
| B. | 1L 1mol/L 醋酸溶液中分子總數小于NA | |
| C. | 在1mol-CHO中所含電子數為15NA | |
| D. | 1mol CaHxNbOc的有機物中,H最多(2a+b+2)NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 點燃爆竹后,硫燃燒生成SO3 | |
| B. | 中國古代利用明礬溶液的酸性清除銅鏡表面的銅銹 | |
| C. | 服用阿司匹林出現水楊酸反應時,用NaHCO3溶液解毒 | |
| D. | 使用含鈣離子濃度較大的地下水洗衣服,肥皂去污能力減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- | |
| C. | 酸性溶液中KIO3與KI反應生成I2:IO3-+I-+6H+=I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反應在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 該溫度下反應平衡常數為1.62×10-3L/mol | |
| C. | 相同溫度下,起始時向容器中充入4 mol SO3,達到平衡時,SO3的轉化率大于10% | |
| D. | 溫度不變,向該容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反應達到新平衡時SO3轉化率升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | △H1=△H2+△H3 | |
| C. | Cl、Br、I的非金屬性依次減弱,所以途徑Ⅱ吸收的熱量按Cl、Br、I的順序依次增多 | |
| D. | 途徑Ⅰ生成HCl放出的熱量比生成HBr的多,說明HCl比HBr穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

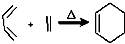 RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.請按要求回答下列問題:
RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.請按要求回答下列問題: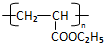 .
.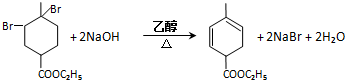 .
. 均2個,反應④的化學方程式為
均2個,反應④的化學方程式為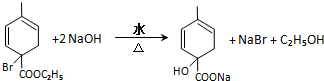 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com