
【題目】高溫下,某反應達到平衡,平衡常數K=![]() 。恒容時,溫度升高,H2濃度減小。下列說法正確的是( )
。恒容時,溫度升高,H2濃度減小。下列說法正確的是( )
A. 該反應的焓變為正值
B. 恒溫下,增大壓強,H2濃度一定減小
C. 升高溫度,逆反應速率減小
D. 該反應為放熱反應
科目:高中化學 來源: 題型:
【題目】50 mL 0.50 mol·L1鹽酸與50 mL 0.55 mol·L1 NaOH溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
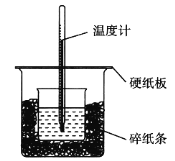
(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是______________________________。
(2)燒杯間填滿碎紙條的作用是______________。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數值__________(填”偏大”“偏小”或”無影響”)。
(4)實驗中改用60 mL 0.50 mol·L1鹽酸跟50 mL 0.55 mol·L1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量__________(填”相等”或”不相等”),所求中和熱__________(填”相等”或”不相等”),簡述理由:_________________________。
(5)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會__________(填”偏大”“偏小”或”無影響”,下同);用50 mL 0.50 mol·L1 NaOH溶液進行上述實驗,測得的中和熱的數值會__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各物質中只有A、B、C三種單質,A的焰色反應為黃色,主要以G形式存在于海水中,F是一種淡黃色的固體,H是一種常見的無色液體,I是造成溫室效應的“元兇”,各物質間的轉化關系圖如下:
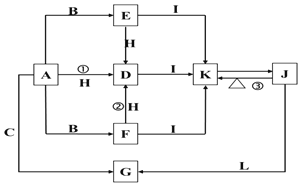
請按要求書寫:
(1)反應①的離子方程式: ____________________________________;
(2)物質K與物質L等物質的量離子方程式:___________________________;
(3)物質F轉化為D的離子方程式:___________________________________;
(4)物質G向物質J轉化的化學方程式:_______________________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向a L密閉容器中加入1 mol X氣體和2 mol Y氣體,發生如下反應:X(g)+2Y(g)![]() 3Z(g)。此反應達到平衡的標志是
3Z(g)。此反應達到平衡的標志是
A. 容器內壓強不隨時間變化
B. 容器內各物質的濃度不隨時間變化
C. 容器內X、Y、Z的濃度之比為l∶2∶3
D. 單位時間消耗0.1 mol X同時生成0.3 mol Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究大氣中含硫化合物(主要是SO2和H2S)的轉化具有重要意義。
(1)高濕條件下,寫出大氣中SO2轉化為HSO3-的方程式: 。
(2)土壤中的微生物可將大氣中H2S經兩步反應氧化成SO42-,兩步反應的能量變化示意圖如下:
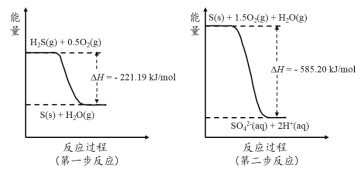
1mol H2S(g)全部氧化成SO42-(aq)的熱化學方程式為 。
(3)二氧化硫—空氣質子交換膜燃料電池可以利用大氣所含SO2快速啟動,其裝置示意圖如下:
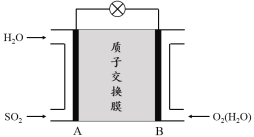
① 質子的流動方向為 (“從A到B”或“從B到A”)。
② 負極的電極反應式為 。
(4)燃煤煙氣的脫硫減排是減少大氣中含硫化合物污染的關鍵。SO2煙氣脫除的一種工業流程如下:
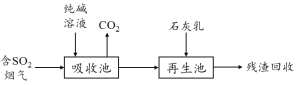
用純堿溶液吸收SO2將其轉化為HSO3-,反應的離子方程式是 。
若石灰乳過量,將其產物再排回吸收池,其中可用于吸收SO2的物質的化學式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子反應方程式正確的是( )
A. 硫酸亞鐵溶液中加入用硫酸酸化的過氧化氫溶液:2Fe2++2H++H2O2= 2Fe3++2H2O
B. 電解飽和食鹽水:2Cl-+2H2O![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C. 鐵和稀硝酸反應:Fe+ 2H+=Fe2++ H2↑
D. 硫酸氫鈉溶液中逐滴加入氫氧化鋇溶液直至溶液呈中性: H++ SO42- + OH-+ Ba2+ = BaSO4↓+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池是符合綠色化學理念的新型發電裝置。如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:

(1)氫氧燃料電池能量轉化的主要形式是____________________________________________,在導線中電子流動方向為________(用a、b表示)。
(2)負極反應式為________________________________________________________________。
(3)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反應Ⅰ中的還原劑是________,反應Ⅱ中的氧化劑是________。
②金屬鋰吸收的氫氣與放出的氫氣的物質的量之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實。某化學興趣小組通過在實驗室中模擬上述過程,其設計的模擬裝置如下:
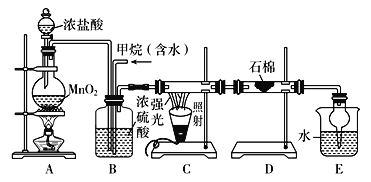
根據設計要求回答:
(1)B裝置有三種功能:①控制氣流速度; ②均勻混合氣體; ③____________。
(2)設![]() =x,若理論上欲獲得最多的氯化氫,則x取值范圍________。
=x,若理論上欲獲得最多的氯化氫,則x取值范圍________。
(3)D裝置的石棉中均勻混有KI粉末,其作用是______________。
(4)E裝置的作用是________(填編號)。
A 收集氣體 B 吸收氯氣
C 防止倒吸 D 吸收氯化氫
(5)在C裝置中,經過一段時間的強光照射,發現硬質玻璃管內壁有黑色小顆粒產生,寫出置換出黑色小顆粒的化學方程式:_______________________________________。
(6)E裝置中除生成鹽酸外,還含有有機物,從E中分離出有機物的最佳方法為________。該裝置還有缺陷,原因是沒有進行尾氣處理,其尾氣主要成分為________(填編號)。
a CH4 b CH3Cl c CH2Cl2 d CHCl3 e CCl4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以太陽能為熱源分解Fe3O4,經熱化學鐵氧化合物循環分解水制比的過程如圖所示。下列敘述正確的是( )

A.H2的標準燃燒熱△H<-(△H1+△H2)
B.過程I適當降低反應體系溫度,反應更有利
C.過程II中3mo1FeO(s)的總能量高于lmolFe3O4(s)
D.增加鐵氧化合物的質量可以顯著提高循環制H2的速率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com