
【題目】汽車尾氣中含有CO、NO、NO2、碳氫化合物等多種污染物。回答下列問題:
(1)汽車燃料中不含氮元素,尾氣中所含NO產生的原因是_________________________(用化學方程式表示)。
(2)已知:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g) △H1=-5316 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746 kJ·mol-1
①若H2O(l)=H2O(g) △H=+44 kJ·mol-1,則表示正丁烷燃燒熱的熱化學方程式為__________________。
②部分化學鍵鍵能數據為:氧分子中氧氧鍵的鍵能為494 kJ·mol-1;C=O的鍵能為799 kJ·mol-1;CO分子中碳氧鍵的鍵能為1076 kJ·mol-1;請計算出反應2CO(g)+O2(g)=2CO2(g)的△H=______________kJ·mol-1,由此可以計算△H2=__________kJ·mol-1
(3)1573K時,N2+O2![]() 2NO平衡常數為2.0×10-6,若測得內燃機內平衡混合氣中氮氣、氧氣的物質的量分別為0.2mol、0.001mol,則生成NO的物質的量為_____________mol,N2的轉化率為____________。
2NO平衡常數為2.0×10-6,若測得內燃機內平衡混合氣中氮氣、氧氣的物質的量分別為0.2mol、0.001mol,則生成NO的物質的量為_____________mol,N2的轉化率為____________。
(4)T<500K時,反應NO2(g)+CO(g)=NO(g)+CO2(g)分兩步進行:
第一步:NO2(g)+NO2(g)=NO3(g)+NO(g) (慢反應)
第二步:NO3(g)+CO(g)=NO(g)+CO2(g) (快反應)
下列表述正確的是__________(填標號)
A.反應速率與NO2濃度有關 B.反應速率與NO濃度有關
C.反應的中間產物只有NO3 D.第一步反應活化能較低
【答案】N2+O2![]() 2NO C4H10(g) +
2NO C4H10(g) +![]() O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 -550 +196 2.0×10-5 0.005% AC
O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 -550 +196 2.0×10-5 0.005% AC
【解析】
(1)進入氣缸的氣體是空氣,含有氮氣和氧氣在高溫下反應;
(2)①根據蓋斯定律計算;
②△H=反應物的總鍵能-生成物的總鍵能;
(3)利用平衡常數和三段式進行計算;
(4)利用反應原理分析;
(1)進入氣缸的氣體是空氣,含有氮氣和氧氣在高溫下反應生成一氧化氮,污染空氣,方程式是N2+O2![]() 2NO ,
2NO ,
故答案是:N2+O2![]() 2NO ;
2NO ;
(2)① ①2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g) △H1=-5316 kJ·mol-1
②H2O(l)=H2O(g) △H=+44 kJ·mol-1,
(①-②×10)÷2得
C4H10(g) +![]() O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1
O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1
故答案為:C4H10(g) +![]() O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 ;
O2 (g) = 4CO2(g) + 5H2O(l) ΔH=-2878 kJ·mol-1 ;
②△H=反應物的總鍵能-生成物的總鍵能=2×1076 kJ·mol-1+494 kJ·mol-1-2×2×799 kJ·mol-1=-550 kJ·mol-1;
①2CO(g)+O2(g)=2CO2(g) △H=-550kJ·mol-1
②2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746 kJ·mol-1
有蓋斯定律得:①-②得N2(g)+O2(g)=2NO(g) △H2=196 kJ·mol-1
故答案為:-550;+196;c(NO)2
(3) N2+O2![]() 2NO,K=
2NO,K=![]() =
=![]() =2.0×10-6,解得n(NO)=2.0×10-5,
=2.0×10-6,解得n(NO)=2.0×10-5,
消耗的氮氣的物質的量是1.0×10-5,氮氣的轉化率=![]() ×100%= 0.005%
×100%= 0.005%
故答案為:2.0×10-5 ;0.005%;
(4)A.第一步是慢反應,決定整個反應的速率快慢,所以反應速率與二氧化氮的濃度有關,故A正確;
B.第二步是快反應,不能決定整個反應速率,故反應速率與一氧化氮的濃度無關,故B錯誤;
C.第一步反應生成的有三氧化氮,三氧化氮又作了第二個反應的反應物,所以是中間產物,故C正確;
D.第一步反應較慢,說明活化能較高,故D錯誤;
故選:AC。


科目:高中化學 來源: 題型:
【題目】碳元素與人們的日常生活、生活和科學研究密不可分。請回答下列問題。
(1)乙烯具有水果催熟的功效,乙烯的電子式是______________。
(2)Al2O3真空碳熱還原一氯化法是一種新的煉鋁工藝,該法流程短,設備簡單,符合目前國家提倡節能減排、改造升級的大環境。
①其中冶煉過程中發生的反應有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
則Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代數式表示)。
②Al4C3是真空碳熱還原一氯化法煉鋁的中間產物,該物質與水反應生成最簡單的有機物。該反應的化學方程式為__________________________________。
(3)利用活性炭的還原性可處理機動車的尾氣(氮氧化物),發生如下反應C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定條件下,密閉容器中的有關物質的濃度與時間的變化如下表所示:
N2(g)+CO2(g) △H>0,一定條件下,密閉容器中的有關物質的濃度與時間的變化如下表所示:
時間/mim 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min內的平均反應速率v(CO2)=_______mol·L-1·min-1;第一次達到平衡的平衡常數K=__________。
②30min時只改變某一條件,則改變的條件可能是______________ (填字母編號)。
a.升高溫度 b.降低溫度 c.再通入一定量的NO
d.縮小容器的體積 e.加入合適的催化劑 f.增大容器休積
(4)煉鋼爐中發生復雜的化學反應,其中包括反應:C(s)+CO2(g)![]() 2CO(g)△H>0。將1molCO2與足量的碳充入到一個恒壓密閉容器中,總壓強為P總。達到平衡時,容器內氣體體積分數與溫度的關系如下圖:
2CO(g)△H>0。將1molCO2與足量的碳充入到一個恒壓密閉容器中,總壓強為P總。達到平衡時,容器內氣體體積分數與溫度的關系如下圖:

①CO2體積分數為86%時,CO2的轉化率為______________%(結果保留一位小數,下同)。
②已知:氣體分壓P分=P總×氣體體積分數,達到平衡時用氣體的分壓代替氣體濃度所表示的平衡常數為Kp,則900℃時,Kp=______________(用含p總的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1)1 mol CO2中含有的σ鍵數目為________,π鍵數目為________。
(2)已知CO和CN-與N2結構相似,CO分子內σ鍵與π鍵個數之比為________。CH2=CHCN分子中σ鍵與π鍵數目之比為________。
(3)肼(N2H4)分子可視為NH3分子中的—個氫原子被-NH2(氨基)取代形成的另一種氮的氫化物。肼可用作火箭燃料,燃燒時發生的反應:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1若該反應中有4 mol N—H鍵斷裂,則形成的π鍵有________mol。
(4)Co 基態原子核外電子排布式為____________;
基態Ge原子的核外電子排布式為____________;
Zn2+的價電子軌道表示式為_______________;
Co3+核外電子未成對電子數為__________________。
(5)CH4、NH3、H2O、HF分子中共價鍵的極性由強到弱的順序是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.據報道,我國在南海北部神狐海域進行的可燃冰(甲烷的水合物)試采獲得成功。甲烷是一種重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外還有以下兩種:
水蒸氣重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
則反應①自發進行的條件是______________,ΔH3=______________kJ·mol-1。
Ⅱ.氮的固定一直是科學家研究的重要課題,合成氨則是人工固氮比較成熟的技術,其原理為N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同溫度、壓強和相同催化劑條件下,初始N2、H2 分別為0.1 mol、0.3 mol時,平衡后混合物中氨的體積分數(φ)如下圖所示。

①其中,p1、p2 和p3 由大到小的順序是______________________________,其原因是__________________________________________________________________。
②若分別用vA(N2)和vB(N2)表示從反應開始至達平衡狀態A、B時的化學反應速率,則vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 為105 Pa條件下,反應達到平衡時容器的體積為1 L,則該條件下B點N2 的分壓p(N2)為_____________________Pa (分壓=總壓×物質的量分數,保留一位小數)。
Ⅲ.以連二硫酸根(S2O![]() )為媒介,使用間接電化學法也可處理燃煤煙氣中的NO,裝置如圖所示:
)為媒介,使用間接電化學法也可處理燃煤煙氣中的NO,裝置如圖所示:

(3)①陰極區的電極反應式為_________________________________。
②NO吸收轉化后的主要產物為NH![]() ,若通電時電路中轉移了0.3 mol e-,則此通電過程中理論上吸收的NO在標準狀況下的體積為________mL。
,若通電時電路中轉移了0.3 mol e-,則此通電過程中理論上吸收的NO在標準狀況下的體積為________mL。
Ⅳ、常溫下,將a mol·L-1的醋酸與b mol·L-1Ba(OH)2 溶液等體積混合,充分反應后,溶液中存在2c(Ba2+)=c(CH3COO-),則該混合溶液中醋酸的電離常數Ka=___________(用含a和b的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中,正確的是 ( )
A. 稀硫酸滴在鐵片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氫鈉溶液與稀鹽酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸銅溶液與氫氧化鈉溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸銀溶液與氯化鈉溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵是一種重要的化工原料,可以制備一系列物質(如下圖),下列說法錯誤的是( )

A. 堿式硫酸鐵水解能產生Fe(OH)3膠體,可用做凈水劑
B. 為防止NH4HCO3分解,生產FeCO3需在較低溫度下進行,該反應的離子方程式為:Fe2++2HCO3-= FeCO3+ CO2↑+H2O
C. 可用KSCN溶液檢驗(NH4)2Fe(SO4)2是否被氧化
D. 該溫度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種重要的消毒劑,可用ClO2為原料制取。某化學興趣小組同學展開對漂白劑亞氯酸鈉(NaClO2)的研究。
已知:飽和NaClO2溶液在溫度低于38 ℃時析出的晶體是NaClO2·3H2O,高于38 ℃時析出的晶體是NaClO2,高于60 ℃時 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用圖所示裝置進行實驗。
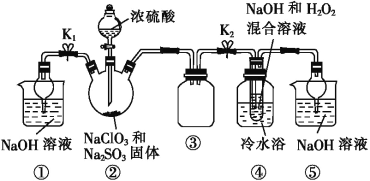
(1)裝置①的作用是___________________,裝置③的作用是________________。
(2)裝置②中制備ClO2的化學方程式為___________________________;裝置④中反應生成NaClO2的化學方程式為_____________________。
(3)從裝置④反應后的溶液中獲得NaClO2晶體的操作步驟為:①減壓,55 ℃蒸發結晶;②趁熱過濾;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能導致產品中混有的雜質是______________。
(4)設計實驗檢驗所得NaClO2晶體是否含有雜質Na2SO4,操作與現象是取少量晶體溶于蒸餾水,__________________________________________________________。
(5)為了測定NaClO2粗品的純度,取10.0 g上述初產品溶于水配成1 L溶液,取出10 mL溶液于錐形瓶中,再加入足量酸化的KI溶液,充分反應后(NaClO2被還原為Cl-,雜質不參加反應),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3標準液滴定,重復2次,平均消耗Na2S2O3溶液20.00 mL,計算得NaClO2粗品的純度為_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學學習小組進行如下實驗。
【探究反應速率的影響因素】設計了如下的方案并記錄實驗結果(忽略溶液混合體積變 化)。限選試劑和儀器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸餾水、 試管、量筒、秒表、恒溫水浴槽
(1)上述實驗①②是探究 對化學反應速率的影響;若上述實驗②③是探究濃度對化學反應速率的影響,則 a 為 ;乙是實驗需要測量的物理量,則表 格中“乙”應填寫 。
【測定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
稱取 1.260 g 純草酸晶體,將其酸制成 100.00 mL 水溶液為待測液。
②取 25.00 mL 待測液放入錐形瓶中,再加入適的稀 H2SO4
③用濃度為 0.05000 mol·L-1 的 KMnO 標準溶液進行滴定;
(2)請寫出與滴定有關反應的離子方程式
(3)某學生的滴定方式(夾持部分略去)如下,最合理的是 (選填 a、b)。


(4)由右圖可知消耗 KMnO4 溶液體積為 mL;
(5)滴定過程中眼睛應注視_________________;
(6)通過上述數據,求得 x= 。以標準 KMnO4 溶液滴定樣品溶液的濃度,未用 標準 KMnO4 溶液潤洗滴定管,引起實驗結果 (偏大、偏小或沒有影響)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錫為ⅣA族元素,四碘化錫是常用的有機合成試劑(SnI4,熔點144.5℃,沸點364.5℃,易水解)。實驗室以過量錫箔為原料通過反應Sn+2I2![]() SnI4制備SnI4。下列說法錯誤的是
SnI4制備SnI4。下列說法錯誤的是
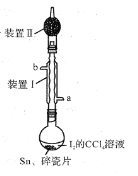
A.裝置Ⅱ的主要作用是吸收揮發的I2
B.SnI4可溶于CCl4中
C.裝置Ⅰ中a為冷凝水進水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com