
【題目】隨著石油資源的日趨緊張,天然氣資源的開發利用受到越來越多的關注。以天然氣(主要成分是CH4)為原料經合成氣(主要成分為CO、H2)制化學品,是目前天然氣轉化利用的主要技術路線。而采用渣油、煤、焦炭為原料制合成氣,常因含羰基鐵[Fe(CO)5]等而導致以合成氣為原料合成甲醇和合成氨等生產過程中的催化劑產生中毒。請回答下列問題:
(1)[Fe(CO)5]中鐵的化合價為0,寫出鐵原子的基態電子排布式:______________________。
(2)與CO互為等電子體的分子為________(填化學式),CO分子的電子式為________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3雜化的分子有________________(填化學式),CH3OH的熔、沸點比CH4高,其主要原因是_________________________________。
【答案】 1s22s22p63s23p63d64s2或[Ar]3d64s2 N2 ![]() CH4、CH3OH CH3OH分子之間有極性,同時分子之間還存在著氫鍵的作用
CH4、CH3OH CH3OH分子之間有極性,同時分子之間還存在著氫鍵的作用
【解析】(1)Fe的原子序數為26,則基態電子排布式為[Ar]3d64s2,故答案為:[Ar]3d64s2;(2)CO分子中C原子上有一對孤對電子,C、O原子都符合8電子穩定結構,則CO的結構式為C≡O,又等電子體中原子數和價電子數都相同,則N2、CN-、CO的原子數都是2,價電子數都是10,則互為等電子體,其中分子為:N2;CO分子的電子式為![]() ;(3)判斷原子采取雜化方式時,先根據價層電子對互斥理論判斷價層電子對,然后再確定采取的雜化方式.價層電子對數=σ鍵電子對數+中心原子上的孤電子對數,σ鍵電子對數=σ鍵個數=中心原子結合的原子個數,中心原子上的孤電子對數=(a-xb)/2,說明:對于分子,a為中心原子的價電子數,x為配位原子個數,b為配位原子最多能接受的電子數.在CH4中價層電子對數=σ鍵電子對數(4)+中心原子上的孤電子對數(0),所以碳原子采取sp3雜化.
;(3)判斷原子采取雜化方式時,先根據價層電子對互斥理論判斷價層電子對,然后再確定采取的雜化方式.價層電子對數=σ鍵電子對數+中心原子上的孤電子對數,σ鍵電子對數=σ鍵個數=中心原子結合的原子個數,中心原子上的孤電子對數=(a-xb)/2,說明:對于分子,a為中心原子的價電子數,x為配位原子個數,b為配位原子最多能接受的電子數.在CH4中價層電子對數=σ鍵電子對數(4)+中心原子上的孤電子對數(0),所以碳原子采取sp3雜化.
在CO分子中價層電子對數=σ鍵電子對數(1)+中心原子上的孤電子對數(1),所以碳原子采取sp雜化.CH3OH中,價層電子對數=σ鍵電子對數(4)+中心原子上的孤電子對數(0),所以碳原子采取sp3雜化; CH3OH分子之間有極性,CH3OH形成分子間氫鍵,沸點升高。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】目前, 我市電能的主要來源是火力發電。 下列關于火力發電過程中能量轉化關系的描述,正確的是
A. 化學能轉化成機械能再轉化成電能
B. 化學能轉化成熱能再轉化成電能
C. 化學能轉化成機械能再轉化成熱能再到機械能
D. 化學能轉化成熱能再轉化成機械能再到電能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的數值,下列敘述正確的是
A. a g C2H4和C3H6的混合物所含原子總數為![]()
B. 常溫常壓下,14 g由N2與CO組成的混合氣體含有的原子數目為NA
C. 標準狀況下,22.4 L H2O含有的分子數為 NA
D. 物質的量濃度為0.5 mol·L1的MgCl2溶液中,含有Cl個數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠的工業廢水中含有大量的FeSO4 、較多的Cu2+和少量的Na+。為了減少污染并變廢為寶,工廠計劃從該廢水回收硫酸亞鐵和金屬銅。請根據流程圖,回答下列問題:

(1)物質X的化學式為________,操作1的名稱:________
(2)寫出A中主要成分的化學式:_____,在A中加入Y的離子方程式為:__________________
(3)工業廢水中加入X所發生的離子方程式為:__________________________________;是否氧化還原反應____________(填“是”或“否”),如果是氧化還原反應,發生還原反應的是:______________(若非氧化還原反應則說明理由)。
(4)操作中的操作3是:___________、冷卻結晶、過濾、洗滌、烘干。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用足量鎂粉與一定量的某濃度的鹽酸反應來制得氫氣。由于反應速率太快,不易操作。為減慢反應速率,同時又不影響生成H2的總量,可向鹽酸中加入的物質是
A.CH3COONa固體 B.NaOH溶液 C.(NH4)2SO4粉末 D.K2SO4固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氨的水溶液顯弱堿性,其原因為___________________(用離子方程式表示), 0.1 molL-1的氨水中加入少量的NH4Cl固體,溶液的pH________(填“升高”或“降低”);若加入少量的明礬,溶液中的NH4+的濃度__________(填“增大”或“減小”);
(2)25℃,兩種酸的電離平衡常數如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的電離平衡常數表達式K=___________________;
②0.10molL-1Na2SO3溶液中離子濃度由大到小的順序為___________________;
③H2SO3溶液和NaHCO3溶液反應的離子方程式為___________________;
(3)銀是一種貴金屬,古代常用于制造錢幣及裝飾器皿,現代在電池和照明器材等領域亦有廣泛應用。已知Ksp(AgCl)=1.8×10-10,若向5mL0.018molL-1的AgNO3溶液中加入5mL0.020molL-1的鹽酸,混合后溶液中的Ag+的濃度為______molL-1,pH為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向密閉容器中充入物質A和B,發生反應aA(g)+bB(g)![]() cC(g)。反應過程中,物質A的體積分數
cC(g)。反應過程中,物質A的體積分數
和C的體積分數隨溫度(T)的變化曲線如圖所示。下列說法正確的是
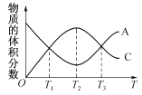
A.該反應在T1、T3溫度時達到化學平衡 B.該反應在T2溫度時達到化學平衡
C.該反應的逆反應是放熱反應 D.升高溫度,平衡會向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機高分子合成材料的出現是材料發展史上的一次重大突破,下列屬于有機高分子合成材料的一組是( )
①家用保鮮袋 ②不銹鋼 ③淀粉 ④尼龍布 ⑤汽車輪胎
A.①④⑤B.②③④C.②③⑤D.只有①⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com