
【題目】下列垃圾或廢棄物的處理不符合環保節約理念的是
A.廢紙、塑料瓶、廢鐵回收再利用B.廚余垃圾采用生化處理或堆肥
C.稻草、一次性餐具露天焚燒D.廢電池等有毒有害垃圾分類回收
科目:高中化學 來源: 題型:
【題目】有機物W用作調香劑、高分子材料合成的中間體等,制備W的一種合成路線如下。
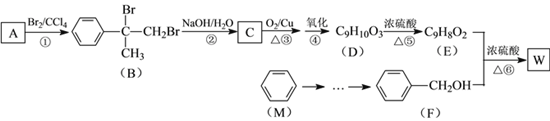
已知:![]()
請回答下列問題:
(1)F的化學名稱是_________,②的反應類型是_________。
(2)D中含有的官能團是________________(寫名稱),D聚合生成高分子化合物的結構簡式為_____________。
(3)反應③的化學方程式是______________________。
(4)反應⑥的化學方程式是______________________。
(5)芳香化合物N是A的同分異構體,其中核磁共振氫譜為三組峰的結構簡式為
_______________。
(6)參照有機物W的上述合成路線,設計以M為起始原料制備F的合成路線(無機試劑任選)。[示例:![]() ]
]
____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為電解飽和食鹽水的簡易裝置,下列有關說法正確的是:

A. 電解一段時間后往蛋殼中滴加幾滴酚酞,呈紅色
B. 蛋殼表面纏繞鐵絲是陽極
C. 鐵絲表面生成的氣體能使濕潤的淀粉碘化鉀試紙變藍
D. 蛋殼可阻止生成的氯氣與氫氣、氫氧化鈉溶液接觸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】100℃時,向pH=6的蒸餾水中加入NaHSO4晶體,保持溫度不變,測得溶液的pH=2。下列敘述中不正確的是:
A. 此時水的離子積Kw=1×10-14 B. 水電離出的c(H+)=1×10-10molL-1
C. 水的電離程度隨溫度升高而增大 D. c(Na+)=c(SO42-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A.元素周期表是元素按相對原子質量大小排列而成的
B.元素周期表共有9個周期和18個族
C.在金屬元素與非金屬元素的分界線附近尋找半導體材料
D.第IA族元素,原子序數越大,金屬性越弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗測得25℃、101 kPa時,1 mol甲醇完全燃燒釋放726.51kJ的熱量,下列熱化學方程式書寫正確的是( )
A. 2CH3OH+3O2=2CO2+4H2O ΔH=-1453.02 kJ·mol-1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=+1453.02 kJ·mol-1
C. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-1
D. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用焦炭在石灰窯中燃燒放熱,使石灰石分解生產CO2。主要反應如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸鈣95%的石灰石2.0 t按②完全分解(設雜質不分解),可得標準狀況下CO2的體積為_________________m3。
(2)純凈的CaCO3和焦炭按①②完全反應,當窯內配比率![]() =2.2時,窯氣中CO2的最大體積分數為多少?(設空氣只含N2與O2,且體積比為4∶1,下同)
=2.2時,窯氣中CO2的最大體積分數為多少?(設空氣只含N2與O2,且體積比為4∶1,下同)
(3)某次窯氣成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余為N2。則此次窯內配比率![]() 為何值?
為何值?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“低碳生活,綠色出行”已經成為很多人的生活理念。CO2的捕捉和利用也成為了科學家們積極探索的熱門領域。回答下列問題:
(1)用CO2催化加氫可制取乙烯,其能量關系如圖1,寫出該反應的熱化學方程式____________。

(2)以硫酸作電解質溶液,利用太陽能電池將CO2轉化為乙烯的工作原理如圖2。則A為電池的___極,N極的電極反應式為_________________________。
(3)用CO2催化加氫制取二甲醚的反應為:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在恒容密閉容器中,均充入2mol.CO2和6molH2,分別以Ir和Ce作催化劑,反應進行相同的時間后測得的CO2的轉化率a(CO2)隨反應溫度的變化情況如圖3。

①用Ir和Ce作催化劑時,反應的活化能更低的是_______。
②a、b、c、d和e五種狀態,反應一定達到平衡狀態的是__________,反應的△H ___0(填“>”、“=”或“<”)。
③從狀態a到c,CO2轉化率不斷增大的原因是________________________________。
④狀態e時,a(CO2)= 50%,若保持容器容積為10L,則此時的平衡常數K=____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鈉在制革工業、印刷工業、電鍍工業等有重要用途,制備重鉻酸鈉(Na2Cr2O7)的方案1的流程圖如圖,鉻鐵礦的主要成分可表示為FeO·Cr2O3,還含有Al2O3、Fe2O3、SiO2等雜質。

除此外工廠還有相關改進工藝,制備重鉻酸鈉(Na2Cr2O7)的方案2如圖,采用電化學原理如圖所示的裝置(電極為石墨),通過電解提高陽極區溶液的酸性,實現Na2CrO4轉化為Na2Cr2O7。

(1)在方案2中請指明哪端是陰極? ___________(填“左”或“右”)。寫出陽極的電極方程式:______________________。
(2)方案1中煅燒前應將鉻鐵礦充分粉碎,其目的是______________________。灼燒是中學化學中常用的操作方法,如在實驗室中將鉻鐵礦和碳酸鈉固體混合物灼燒,下列各實驗儀器中不需要的是___________(填序號)。
a.陶瓷坩堝 b.鐵坩堝 c.三腳架 d.泥三角
轉窯中發生的主要反應除了下面的兩個反應外,還有其他反應。
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②_____FeO·Cr2O3+______Na2CO3+______O2![]() ______Na2CrO4+______Fe2O3+______。
______Na2CrO4+______Fe2O3+______。
請配平反應②的化學方程式。
請寫出其他主要反應方程式:_________________________________。
(3)固體Y的化學式為___________、___________。
(4)向母液中加入濃硫酸,把鉻酸鈉轉化為重鉻酸鈉,經兩次蒸發,主要是除去___________(填化學式),冷卻至30-40℃得到產品晶體。洗滌該晶體的溶劑最好是___________(填序號)。
a.蒸餾水 b無水乙醇 c.75%乙醇溶液
(5)為了測定實驗制得的產品中Na2Cr2O7,的含量,稱取樣品0.140g置于錐形瓶中,加50mL水;再加入2gKI(過量)及稍過量的稀硫酸溶液,搖勻,暗處放置10min;然后加入150mL蒸餾水并加入3mL0.5%淀粉溶液;用0.1000mol/L Na2S2O3標準溶液滴定至終點,消耗Na2S2O3標準溶液30.00mL。(假定雜質不參加反應,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-===2I-+S2O62-)
①終點實驗現象是_______________________________________________________。
②該產品中Na2Cr2O7的純度為______________________。(以質量分數表示)
③若滴定管在滴定前俯視讀數,滴定結束后仰視讀數,測得樣品的純度將___________(填“偏高”或“偏低”或“無影響”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com