
【題目】室溫下,取一定量冰醋酸,進行如下實驗:
① 將冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反應后,測得溶液pH=7;
③ 向②所得溶液中繼續滴加稀鹽酸,直至溶液中n(Na+) = n(Cl-)。
下列說法正確的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①與③所得溶液相比,等體積時所含CH3COOH分子數目相等
 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】現有A、B、C、D四種短周期主族元素,其原子序數依次增大。已知A、C位于同一主族,A在周期表中原子半徑最小。B、D的最外層電子數相等,且B、D的原子序數之和為A、C原子序數之和的兩倍。請回答下列問題:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化學鍵類型有___________;請寫出C2B2與A2B反應的離子方程式________________。
(3)元素B、C形成的簡單離子中半徑較大的是_________(寫電子式)。
(4)僅由C、D兩種元素組成的一種鹽溶于水后pH>7的原因是_____________ (用離子方程式表示)。
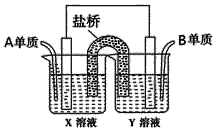
(5)如圖所示以鉑作電極,以C、D兩元素的最高價氧化物的水化物X、Y的溶液作為電解質溶液,A、B元素的單質分別在兩電極上發生原電池反應,則通入B單質的電極反應式為_________,通入A單質的X溶液的pH將__________(填“增大”、“不變”或“減小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是 ( )
A. 乳酸薄荷醇酯(![]() )僅能發生水解、氧化、消去反應
)僅能發生水解、氧化、消去反應
B. 乙醛和丙烯醛(![]() )不是同系物,它們與氫氣充分反應后的產物也不是同系物
)不是同系物,它們與氫氣充分反應后的產物也不是同系物
C. 碳氫質量比為3:1的有機物一定是甲烷
D. 處在不同化學環境中的氫原子在核磁共振氫譜圖上出現的位置不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素鉻(Cr)的幾種化合物存在下列轉化關系:

已知:2CrO42-+2H+![]() Cr2O72-+H2O。下列判斷不正確的是( )
Cr2O72-+H2O。下列判斷不正確的是( )
A.反應①表明Cr2O3有酸性氧化物的性質
B.反應②利用了H2O2的氧化性
C.反應③中溶液顏色變化是由化學平衡移動引起的
D.反應①②③中鉻元素的化合價均發生了變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯可用如圖所示的裝置,填寫下列空白:
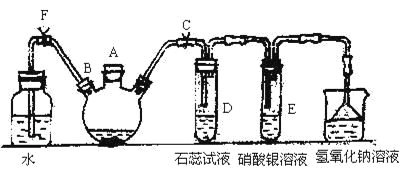
(1)關閉F夾,打開C夾,在裝有少量苯的三口燒瓶中由A口加入少量溴,再加入少量鐵屑,塞住A口,反應一段時間制的溴苯。溴苯是一種密度比水 (填”小”或”大”)的無色液體,在實驗中因為 而顯褐色。則三口燒瓶中發生反應的化學方程式為___ __和__ _。
(2)D、E試管內出現的現象為_____________________________________。
(3)待三口燒瓶中的反應進行到仍有氣泡冒出時松開F夾,關閉C,可以看到的現象是__________________。
(4)三口燒瓶中的溴苯經過下列步驟分離提純:
①向三口燒瓶中加入10 mL水,然后過濾除去未反應的鐵屑;
②濾液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗滌。NaOH溶液洗滌的作用是______________________;
③向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾。加入氯化鈣的目的是___。
(5)經過上述分離操作后,粗溴苯中還含有的主要雜質為_____________,要進一步提純,下列操作中必須的是_______(填入正確選項前的字母):
A.重結晶 B.過濾 C.蒸餾 D.萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化物在自然界中的部分循環關系如圖。
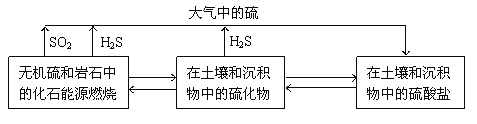
(1)H2S在空氣中可以燃燒。
已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.38kJ/mol
S(s)+O2(g)=SO2(g) ΔH=-297.04kJ/mol
H2S(g)與O2(g)反應產生SO2(g)和H2O(g)的熱化學方程式是____。
(2)SO2是大氣污染物,海水具有良好的吸收SO2的能力,其過程如下。
①SO2溶于海水生成H2SO3,H2SO3最終會電離出SO32-,SO32-可以被海水中的溶解氧氧化為SO42-。海水的pH會____(填“升高”、“不變”或“降低”)。
②為調整海水的pH,可加入新鮮的海水,使其中的HCO3-參與反應,其反應的離子方程式是____。
③在上述反應的同時需要大量鼓入空氣,其原因是____。
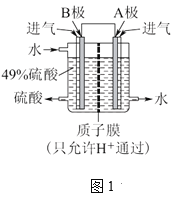
(3)某科研單位利用工業廢氣中的SO2來制取H2SO4。
①利用原電池原理,用SO2和O2來制備硫酸,裝置如圖1所示。B極的電極反應式是____。
②SO2經圖2中的兩個循環可分別得到S和H2SO4。下列說法正確的是____。
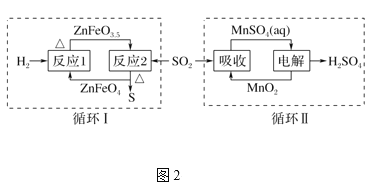
a.循環Ⅰ中,反應1中的氧化產物為ZnFeO3.5
b.循環Ⅰ中,反應2的化學方程式為SO2+4ZnFeO3.5![]() S+4ZnFeO4c.Mn可作為循環Ⅱ中電解過程中的陽極材料
S+4ZnFeO4c.Mn可作為循環Ⅱ中電解過程中的陽極材料
d.循環Ⅰ和循環Ⅱ中消耗同質量的SO2,理論上得到S和H2SO4的質量之比為16∶49
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學以不同方案探究Cu粉與FeCl3溶液的反應。
(1)甲同學向FeCl3溶液中加入Cu粉,觀察到溶液的顏色變為淺藍色,由此證明發生了反應,其離子方程式是__。
(2)乙同學通過反應物的消耗證明了上述反應的發生:將Cu粉加入到滴有少量KSCN的FeCl3溶液中,觀察到溶液紅色褪色,有白色沉淀A產生。
針對白色沉淀A,查閱資料:A可能為CuCl和CuSCN(其中硫元素的化合價為-2價)中的一種或兩種。實驗過程如下:
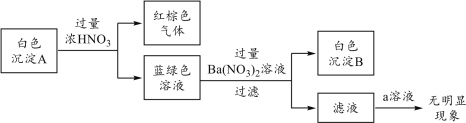
請回答:
①根據白色沉淀B是__(填化學式),判斷沉淀A中一定存在CuSCN。
②僅根據白色沉淀A與過量濃HNO3反應產生的實驗現象,不能判斷白色沉淀A中一定存在CuSCN,從氧化還原角度說明理由:__。
③向濾液中加入a溶液后無明顯現象,說明A不含CuCl,則a是__(填化學式)。
根據以上實驗,證明A僅為CuSCN。
④進一步查閱資料并實驗驗證了CuSCN的成因,將該反應的方程式補充完整:
_Cu2++_SCN-=_CuSCN↓+_(SCN)2
⑤結合上述過程以及Fe(SCN)3![]() Fe3++3SCN-的平衡,分析(2)中溶液紅色褪去的原因:__。
Fe3++3SCN-的平衡,分析(2)中溶液紅色褪去的原因:__。
(3)已知(SCN)2稱為擬鹵素,其氧化性與Br2相近。將KSCN溶液滴入(1)所得的溶液中,觀察到溶液變紅色,則溶液變紅的可能原因是__或__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘酸鉀(![]() )是重要的微量元素碘添加劑。實驗室設計下列實驗流程制取并測定產品中
)是重要的微量元素碘添加劑。實驗室設計下列實驗流程制取并測定產品中![]() 的純度:
的純度:
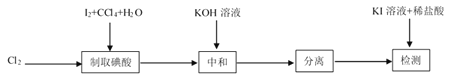
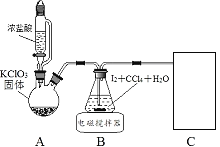
其中制取碘酸(![]() )的實驗裝置見圖,有關物質的性質列于表中
)的實驗裝置見圖,有關物質的性質列于表中
物質 | 性質 |
HIO3 | 白色固體,能溶于水,難溶于CCl4 |
KIO3 | ①白色固體,能溶于水,難溶于乙醇 ②堿性條件下易發生氧化反應:ClO-+IO3-=IO4-+Cl- |
回答下列問題
(1)裝置A中參加反應的鹽酸所表現的化學性質為______________。
(2)裝置B中反應的化學方程式為___________________ 。B中所加CCl4的作用是_________從而加快反應速率。
(3)分離出B中制得的![]() 水溶液的操作為____________;中和之前,需將HIO3溶液煮沸至接近于無色,其目的是____________,避免降低
水溶液的操作為____________;中和之前,需將HIO3溶液煮沸至接近于無色,其目的是____________,避免降低![]() 的產率。
的產率。
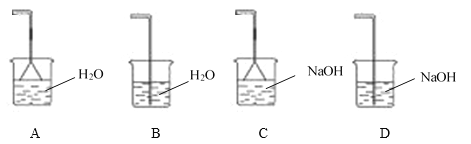
(4)為充分吸收尾氣,保護環境,C處應選用最合適的實驗裝置是____________(填序號)。
(5)為促使![]() 晶體析出,應往中和所得的
晶體析出,應往中和所得的![]() 溶液中加入適量的___________。
溶液中加入適量的___________。
(6)取1.000g![]() 產品配成200.00mL溶液,每次精確量取20.00mL溶液置于錐形瓶中,加入足量KI溶液和稀鹽酸,加入淀粉作指示劑,用0.1004mol/L
產品配成200.00mL溶液,每次精確量取20.00mL溶液置于錐形瓶中,加入足量KI溶液和稀鹽酸,加入淀粉作指示劑,用0.1004mol/L![]() 溶液滴定。滴定至終點時藍色消失(
溶液滴定。滴定至終點時藍色消失(![]() ),測得每次平均消耗
),測得每次平均消耗![]() 溶液25.00mL。則產品中
溶液25.00mL。則產品中![]() 的質量分數為___(結果保留三位有效數字)。
的質量分數為___(結果保留三位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1840年,Devil用干燥的氯氣通過干燥的硝酸銀制得了N2O5。
(1)F.DanielS等曾利用測壓法在剛性反應器中研究了特定條件下N2O5(g)分解反應:
已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4kJmol-1
2NO2(g)=N2O4(g) ΔH2=-55.3kJmol-1
則反應N2O5(g)=2NO2(g)+![]() O2(g)的ΔH=__kJmol-1。
O2(g)的ΔH=__kJmol-1。
(2)查閱資料得知N2O5是硝酸的酸酐,常溫呈無色柱狀結晶體,微溶于冷水,可溶于熱水生成硝酸,熔點32.5℃,受熱易分解,很容易潮解,有毒。在通風櫥中進行模擬實驗制取N2O5的裝置如圖:
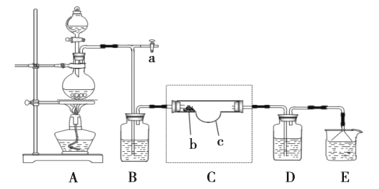
注:虛線框內為該組同學自制特殊儀器,硝酸銀放置在b處。
請回答下列問題:
①實驗開始前,需要打開a處活塞并鼓入空氣,目的是__。
②經檢驗,氯氣與硝酸銀反應的產物之一為氧氣,寫出此反應的化學反應方程式__。
③實驗時,裝置C應保持在35℃,可用的方法是__。
④能證明實驗成功制得N2O5的現象是__。
⑤裝置D中的試劑是__,作用是__。
⑥裝置E燒杯中的試劑為__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com