
【題目】工業燃燒煤、石油等化石燃料釋放出大量氮氧化物(NOx)、CO2、CO、SO2等氣體,嚴重污染空氣。對廢氣進行脫硝、脫碳和脫硫處理可實現綠色環保、廢物利用。
Ⅰ.脫硝:已知:H2的燃燒熱為285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol②H2O(g)=H2O(l) △H2=-44 kJ/mol
寫出在催化劑存在下,H2還原NO2生成水蒸氣和其他無毒物質的熱化學方程式為__。
Ⅱ.脫碳:
(1)向2L恒容密閉容器中加入2molCO2、6molH2,在適當的催化劑作用下,發生反應:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列敘述能說明此反應達到平衡狀態的是___。
A.混合氣體的平均摩爾質量保持不變 B.CO2和H2的體積分數保持不變
C.CO2和H2的轉化率相等 D.混合氣體的密度保持不變
E.1molCO2生成的同時有3molH—H鍵斷裂
(2)在T1℃時,體積為2L的恒容容器中充入物質的量之和為3mol的H2和CO,發生反應CO(g)+2H2(g)![]() CH3OH(g) ΔH=akJ·mol-1。達到平衡時CH3OH的體積分數(V%)與n(H2)/n(CO)的關系如圖1所示。
CH3OH(g) ΔH=akJ·mol-1。達到平衡時CH3OH的體積分數(V%)與n(H2)/n(CO)的關系如圖1所示。

①當起始![]() =3.5時,達到平衡狀態后,CH3OH的體積分數可能是圖象中的__點(選填“D”、“E”或“F”)。
=3.5時,達到平衡狀態后,CH3OH的體積分數可能是圖象中的__點(選填“D”、“E”或“F”)。
②當起始![]() =2時,CO的平衡轉化率與溫度、壓強的關系如圖2所示。則該反應的ΔH__0(填“<”或“>”),圖中壓強P1、P2、P3由大到小的關系是__。T1℃時反應經過5min達到平衡,CO的轉化率為0.4,則0~5min內平均反應速率v(H2)=__。
=2時,CO的平衡轉化率與溫度、壓強的關系如圖2所示。則該反應的ΔH__0(填“<”或“>”),圖中壓強P1、P2、P3由大到小的關系是__。T1℃時反應經過5min達到平衡,CO的轉化率為0.4,則0~5min內平均反應速率v(H2)=__。

【答案】4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ/mol DE F < P1>P2>P3 0.08mol·L-1·min-1
【解析】
Ⅰ.根據蓋斯定律計算H2還原NO2生成水蒸氣和其他無毒物質的焓變;
Ⅱ. (1)根據平衡標志判斷;
(2)①投料比等于系數比,達到平衡時,產物的百分含量最大;
②根據圖象,隨溫度升高,CO平衡轉化率降低;CO(g)+2H2(g)![]() CH3OH(g)正反應氣體系數和減小。
CH3OH(g)正反應氣體系數和減小。
Ⅰ.①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
H2的燃燒熱為285.8kJ/mol,即③H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;
O2(g)=H2O(l)△H=-285.8KJ/mol;
根據蓋斯定律③×4-①-②×4得4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ/mol;
Ⅱ. (1)A.投料比等于系數比,反應過程中CO2、H2的比例不變,所以混合氣體的平均摩爾質量是恒量,混合氣體的平均摩爾質量保持不變,不一定平衡,故不選A;
B. 投料比等于系數比,反應過程中CO2、H2的比例是恒量,CO2和H2的體積分數保持不變,不一定平衡,故不選B;
C. 投料比等于系數比,CO2和H2的轉化率一定相等,所以CO2和H2的轉化率相等,不一定平衡,故不選C;
D.反應過程中有液體生成,所以氣體質量減小,氣體體積不變,密度是變量,混合氣體的密度保持不變,一定達到平衡狀態,故選D;
E.1molCO2生成的同時有3molH—H鍵斷裂,說明正逆反應速率相等,一定達到平衡狀態,故選E。
(2)①投料比等于系數比,達到平衡時,產物的百分含量最大,即![]() =2時,達到平衡狀態后,CH3OH的體積分數最大;當起始
=2時,達到平衡狀態后,CH3OH的體積分數最大;當起始![]() =3.5時,達到平衡狀態后,CH3OH的體積分數低于C點,所以可能是圖象中的F點;
=3.5時,達到平衡狀態后,CH3OH的體積分數低于C點,所以可能是圖象中的F點;
②根據圖象,隨溫度升高,CO平衡轉化率降低,說明升高溫度平衡逆向移動,正反應放熱,ΔH<0;CO(g)+2H2(g)![]() CH3OH(g)正反應氣體系數和減小,壓強越大,CO平衡轉化率越高,所以P1>P2>P3。T1℃時反應經過5min達到平衡,CO的轉化率為0.4,消耗CO的物質的量為1mol×0.4=0.4mol,消耗氫氣的物質的量為0.8mol,0~5min內平均反應速率v(H2)=
CH3OH(g)正反應氣體系數和減小,壓強越大,CO平衡轉化率越高,所以P1>P2>P3。T1℃時反應經過5min達到平衡,CO的轉化率為0.4,消耗CO的物質的量為1mol×0.4=0.4mol,消耗氫氣的物質的量為0.8mol,0~5min內平均反應速率v(H2)=![]() 0.08mol·L-1·min-1。
0.08mol·L-1·min-1。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】工業上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
則CO與H2合成氣態甲醇的熱化學方程式為___________________________________
(2)某科研小組在Cu2O/ZnO作催化劑的條件下,在500℃時,研究了n(H2):n(CO)分別為2:1、5:2時CO的轉化率變化情況(如圖1所示),則圖中表示n(H2):n(CO)=2:1的變化曲線為___________(填“曲線a”或“曲線b”),原因是_______________________________。
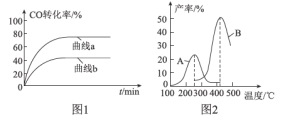
(3)某科研小組向密閉容器中充入一定量的CO和H2合成氣態甲醇,分別在A、B兩種不同催化劑作用下發生反應,一段時間后測得CH3OH的產率與溫度的關系如圖2所示。下列說法正確的是____________(填選項字母)。
a.使用催化劑A能加快相關化學反應速率,但催化劑A并未參與反應
b.在恒溫恒壓的平衡體系中充入氬氣,CH3OH的產率降低
c.當2v(CO)正=v(H2)逆時,反應達到平衡狀態
(4)一定溫度下,在容積均為2L的兩個恒容密閉容器中,按如下方式加入反應物,一段時間后達到平衡。

若甲容器平衡后氣體的壓強為開始時的![]() ,則該溫度下,該反應的平衡常數K=______,要使平衡后乙容器與甲容器中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,則乙容器中c的取值范圍為_____________________________________。
,則該溫度下,該反應的平衡常數K=______,要使平衡后乙容器與甲容器中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,則乙容器中c的取值范圍為_____________________________________。
(5)CO與日常生產生活相關。
①檢測汽車尾氣中CO含量,可用CO分析儀,工作原理類似于燃料電池,其中電解質是氧化釔(Y2O3)和氧化鋯(ZrO2)晶體,能傳導O2-。則負極的電極反應式為__________________。
②碳酸二甲醋[(CH3O)2CO]毒性小,是一種綠色化工產品,用CO合成(CH3O)2CO,其電化學合成原理為4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,裝置如圖3所示:
2(CH3O)2CO+2H2O,裝置如圖3所示:
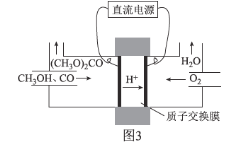
寫出陽極的電極反應式:________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著時代的發展,綠色環保理念越來越受到大家的認同,變廢為寶是我們每一位公民應該養成的意識。某同學嘗試用廢舊的鋁制易拉罐作為原材料、采用“氫氧化鋁法”制取明礬晶體并進行一系列的性質探究。
制取明礬晶體主要涉及到以下四個步驟:
第一步:鋁制品的溶解。取一定量鋁制品,置于250mL錐形瓶中,加入一定濃度和體積的強堿溶液,水浴加熱(約93℃),待反應完全后(不再有氫氣生成),趁熱減壓抽濾,收集濾液于250mL燒杯中;
第二步:氫氧化鋁沉淀的生成。將濾液重新置于水浴鍋中,用3 mol/L H2SO4調節濾液pH至8~9,得到不溶性白色絮凝狀Al(OH)3,減壓抽濾得到沉淀;
第三步:硫酸鋁溶液的生成。將沉淀轉移至250mL燒杯中,邊加熱邊滴入一定濃度和體積的H2SO4溶液;
第四步:硫酸鋁鉀溶液的形成。待沉淀全部溶解后加入一定量的固體K2SO4,將得到的飽和澄清溶液冷卻降溫直至晶體全部析出,減壓抽濾、洗滌、抽干,獲得產品明礬晶體[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列問題:
(1)第一步鋁的溶解過程中涉及到的主要反應的離子方程式為__________________________
(2)為了加快鋁制品的溶解,應該對鋁制品進行怎樣的預處理:________________________
(3)第四步操作中,為了保證產品的純度,同時又減少產品的損失,應選擇下列溶液中的___(填選項字母)進行洗滌,實驗效果最佳。
A.乙醇 B.飽和K2SO4溶液 C.蒸餾水 D.1:1乙醇水溶液
(4)為了測定所得明礬晶體的純度,進行如下實驗操作:準確稱取明礬晶體試樣4.0g于燒杯中,加入50mL 1mol/L鹽酸進行溶解,將上述溶液轉移至100mL容量瓶中,稀釋至刻度線,搖勻;移取25.00 mL溶液干250 mL錐形瓶中,加入30 mL 0.10mol/L EDTA-2Na標準溶液,再滴加幾滴2D二甲酚橙,此時溶液呈黃色;經過后續一系列操作,最終用0.20 mol/L鋅標準溶液滴定至溶液由黃色變為紫紅色,達到滴定終點時,共消耗5.00 mL鋅標準溶液。滴定原理為H2Y2-+Al3+→AlY-+2H+,H2Y2-(過量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na標準溶液離子)。則所得明礬晶體的純度為_________%。
(5)明礬除了可以用作人們熟悉的凈水劑之外,還常用作部分食品的膨松劑,例如油條(餅)的制作過程需要加入一定量的明礬,請簡述明礬在面食制作過程作膨松劑的原理:_______
(6)為了探究明礬晶體的結晶水數目及分解產物,在N2氣流中進行熱分解實驗,得到明礬晶體的熱分解曲線如圖所示(TG%代表的是分解后剩余固體質量占樣品原始質量的百分率,失重百分率=![]() ×100%):
×100%):
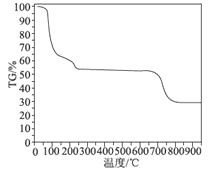
根據TG曲線出現的平臺及失重百分率,30~270℃范圍內,失重率約為45.57%,680~810℃范圍內,失重百分率約為25.31%,總失重率約為70.88%,請分別寫出所涉及到30~270℃、680~810℃溫度范圍內這兩個階段的熱分解方程式:___________、_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖所示為常見氣體制備、干燥、性質驗證和尾氣處理的部分儀器裝置(加熱設備及夾持固定裝置均略去),請根據要求完成下列各題,儀器裝置可任意選用,必要時可重復選擇。
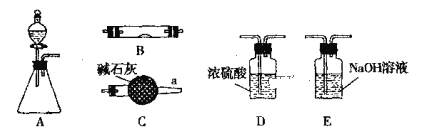
(1)若錐形瓶中盛裝鋅片,分液漏斗中盛裝稀硫酸,可驗證H2的還原性并檢驗其氧化產物。
①當儀器連接順序為A→D→B→B→C時,兩次使用B裝置,其中所盛的藥品依次是CuO、____________。
②檢查好裝置的氣密性后加熱B前必須進行的操作是_________________ 。
(2)若錐形瓶中盛裝Na2O2固體,分液漏斗中盛裝濃氨水,B中盛裝固體催化劑,可進行氨的催化氧化,其反應產物為NO和H2O。
①各儀器裝置按氣流方向從左到右連接順序A→C→B→C,請寫出B中氨的催化氧化反應方程式____________________________ 。
②裝置B中可能觀察到的現象是_____________________________。
(3)若錐形瓶中盛裝Na2SO3固體,分液漏斗中盛裝H2SO4溶液,B中盛裝Na2O2固體,可探究SO2氣體與過氧化鈉反應時是否有O2生成。根據氣流方向,裝置的連接順序為:A→D→B→E,根據實驗現象回答問題:
①若將帶余燼的木條靠近E的導管口,木條復燃,SO2表現酸性氧化物的性質,則反應的方程式可能為:____________________;
②若在E的導管口未收集到任何氣體,SO2只表現還原性,則反應的方程式可能為:____________________。
③裝置B中觀察到的現象是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E、F六種元素,已知:
①它們位于三個不同短周期,核電荷數依次增大
②E元素的電離能數據見下表(kJ·mol-1):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
③B與F分別同主族
④A、E分別都能與D按原子個數比1﹕1或2﹕l形成化合物
⑤B、C分別都能與D按原子個數比1﹕1或1﹕2形成化合物
(1)寫出只含有A、B、D、E四種元素的兩種無水鹽的化學式_____________、______________
(2)B2A2分子中存在____個σ鍵,____個π鍵
(3)E2D2電子式____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、鉻及其相關化合物用途非常廣泛。回答下列問題:
(1)基態N原子的核外電子排布式為___,Cr位于元素周期表第四周期___族。
(2) Cr與K位于同一周期且最外層電子數相同,兩種元素原子第一電離能的大小關系為___;Crcl3的熔點(83℃)比CrF3的熔點(1100℃)低得多,這是因為___。
(3) Cr的一種配合物結構如圖所示:

①陰離子C1O4-的空間構型為___形。
②配離子中,中心離子的配位數為___,N與中心原子形成的化學鍵稱為___鍵。
③配體H2 NCH2 CH2 NH2(乙二胺)中碳原子的雜化方式是______ ,分子中三種元素電負性從大到小的順序為___
(4)氮化鉻的熔點為1770℃,它的一種晶體的晶胞結構如圖所示,其密度為5. 9 g·cm -3,氮化鉻的晶胞邊長為___(列出計算式)nm.

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式書寫正確且對應的△H的數值和意義與括號內表述相符的是( )
A. 2H2 (g) + O2 (g) = 2H2O (l) ΔH=-571.6 kJ/mol(燃燒熱)
B. NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和熱)
C. H2O(g)=H2(g)+1/2 O2(g) ΔH=-242 kJ/mol (反應熱)
D. C(s)+ O2 ( g )=CO2(g) ΔH=-393.5 kJ/mol(反應熱)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2CO3溶液中存在平衡:CO32- + H2O![]() HCO3- + OH-,下列有關說法正確的是( )
HCO3- + OH-,下列有關說法正確的是( )
A.離子濃度:c(Na+) > c(CO32-) > c(OH-) > c(H+)
B.升高溫度,平衡向逆反應方向移動
C.加入NaCl溶液,溶液的pH增大
D.加入NaOH固體,溶液的pH減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的Mg和Al的混合物投入![]() 的稀硫酸中,固體全部溶解并產生氣體。待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液體積的關系如圖所示。則下列說法正確的是
的稀硫酸中,固體全部溶解并產生氣體。待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液體積的關系如圖所示。則下列說法正確的是![]()
![]()
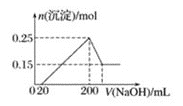
A.Mg、Al的混合物與![]() 的稀硫酸恰好完全反應
的稀硫酸恰好完全反應
B.生成![]() 的體積為
的體積為![]()
C.當加入20mL氫氧化鈉溶液時,溶液中的溶質只有硫酸鎂和硫酸鋁
D.NaOH溶液的物質的量濃度為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com