
【題目】下列對化學反應的說法正確的是( )
A.化學反應過程中,分子的種類一定發生改變
B.已知2A(g)+B(g)C(g)+D(s)△H<0,則該反應一定能自發進行
C.有化學鍵發生斷裂,就有化學反應的發生
D.放熱反應的反應速率一定比吸熱反應的反應速率大
科目:高中化學 來源: 題型:
【題目】常溫下氨能被Cl2、Br2、H2O2等氧化,已知以下反應:8NH3+3Cl2→6NH4Cl+N2
已知該反應中,氨氣不足時,也會有HCl產生。
(1)用單線橋標出電子轉移的方向和數目。________
(2)這一反應中,氧化劑是________,氧化產物是________。
(3)若有3 mol N2生成,則發生氧化反應的物質有________mol。
(4)根據上述反應,若將濃氨水與Cl2靠近,將會看到______________________(現象)。
(5)當0.5LNH3與0.3LCl2充分反應后,氣體的體積變為________L,若收集一瓶該產物氣體,并使用該氣體進行噴泉實驗,并用紫色石蕊溶液作指示劑,最終溶液呈________色。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖海水綜合利用的工業流程圖,判斷下列說法正確的是( )
已知:MgCl2·6H2O受熱生成Mg(OH)Cl和HCl氣體等。
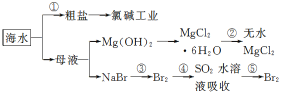
A.除去粗鹽中雜質(Mg2+、SO42-、Ca2+),加入的藥品順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→過濾后加鹽酸
B.在過程②中將MgCl2·6H2O灼燒即可制得無水MgCl2
C.從能量轉換角度來看,氯堿工業中的電解飽和食鹽水是一個將化學能轉化為電能的過程
D.從第③步到第⑤步的目的是為了制取并提純Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向H2C2O4溶液中逐滴加入NaOH溶液,所得溶液中H2C2O4,HC2O4-,C2O42-三者物質的量分數(分布系數)隨pH變化的關系入左圖所示。右圖為不同濃度NaHC2O4溶液中部分微粒濃度。下列表述錯誤的是
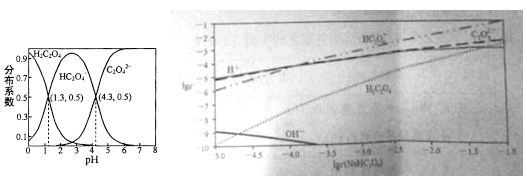
A. HC2O4-![]() H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 將等物質的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好為4.3
C. NaHC2O4溶液中一定存在c(C2O42-)>c(H2C2O4),同時c(H+)>c(OH-)
D. 在0.1mol/L NaHC2O4溶液中各離子濃度大小關系為:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下在一容積不變的密閉容器中發生可逆反應2X(g) ![]() Y(g)+Z(s),以下不能說明該反應達到化學平衡狀態的是( )
Y(g)+Z(s),以下不能說明該反應達到化學平衡狀態的是( )
A. 混合氣體的密度不再變化 B. 反應容器中Y的質量分數不變
C. X的分解速率與Y的消耗速率相等 D. 單位時間內生成1 mol Y的同時生成2 mol X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y和Z三種元素的原子序數之和等于42。X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子。X跟Y可形成化合物X2Y3,Z元素可以形成負一價離子。請回答下列問題:
(1)X元素原子的基態電子排布式為 ,該元素的符號是 。
(2)Y元素原子的價層電子的電子排布圖為 ,該元素的名稱是 。
(3)X與Z可形成化合物XZ3,該化合物的空間構型為 。
(4)比較X的氫化物與同族第二、三周期元素所形成的氫化物的穩定性順序(由大到小) ,沸點順序(由高到低) 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),在5 L密閉容器中進行,半分鐘后,NO的物質的量增加了0.3 mol,則此反應的平均速率為( )
4NO(g)+6H2O(g),在5 L密閉容器中進行,半分鐘后,NO的物質的量增加了0.3 mol,則此反應的平均速率為( )
A. v(O2)=0.01 mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.003 mol/(L·s) D. v(NH3)=0.004 mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)![]() I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)與溫度T的關系如圖所示(曲線上任何一點都表示平衡狀態)。下列說法正確的是( )
I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)與溫度T的關系如圖所示(曲線上任何一點都表示平衡狀態)。下列說法正確的是( )

A.反應 I2(aq)+I﹣(aq)![]() I3﹣(aq)△H>0
I3﹣(aq)△H>0
B.若溫度為T1、T2,反應的平衡常數分別為K1、K2,則K2>K1
C.若T1時,反應進行到狀態d時,一定有υ正>υ逆
D.狀態a與狀態b相比,狀態b時I2的轉化率更高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com