
 硼和氮元素在化學(xué)中有很重要的地位,回答下列問題:
硼和氮元素在化學(xué)中有很重要的地位,回答下列問題: .預(yù)計于2017年發(fā)射的“嫦娥五號”探測器采用的長征5號運載火箭燃料為偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的雜化方式為sp3.
.預(yù)計于2017年發(fā)射的“嫦娥五號”探測器采用的長征5號運載火箭燃料為偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的雜化方式為sp3.分析 (1)硼原子核外電子有5個,電子的運動狀態(tài)沒有相同的;氮原子的價層電子數(shù)5,分別位于2S、2P軌道;(CH3)2NNH2中N原子的價層電子對數(shù)為$\frac{5+3}{2}$=4,據(jù)此判斷N的雜化方式;
(2)同一周期元素的第一電離能隨著原子序數(shù)的增大而呈增大趨勢,但第IIA族、第VA族元素的第一電離能大于相鄰元素的;
(3)①氣態(tài)SeO3分子中中心原子的價層電子對數(shù)可以判斷分子構(gòu)型;
②金屬銅投入氨水或H2O2溶液中均無明顯現(xiàn)象,但投入氨水與H2O2的混合溶液中,則銅片溶解,溶液呈深藍(lán)色,其中過氧化氫為氧化劑,氨與Cu2+形成配離子,兩者相互促進(jìn)使反應(yīng)進(jìn)行,根據(jù)氧化還原反應(yīng)中電子得失守恒和電荷守恒配平;
③該晶胞中距離最近的銅原子和氮原子間的距離為$\frac{\sqrt{2}}{2}$pm,所以晶胞的邊長為$\sqrt{2}$apm,則晶胞的體積為($\sqrt{2}$apm)3,利用均攤法計算晶胞中含有的銅原子和氮原子個數(shù),根據(jù)ρ=$\frac{m}{V}$計算.
解答 解:(1)硼原子核外電子有5個,所以基態(tài)硼原子核外電子有5種不同的運動狀態(tài);氮原子的價層電子數(shù)5,價層電子排布圖為 ,(CH3)2NNH2中N原子的價層電子對數(shù)為$\frac{5+3}{2}$=4,所以N的雜化方式為sp3雜化,
,(CH3)2NNH2中N原子的價層電子對數(shù)為$\frac{5+3}{2}$=4,所以N的雜化方式為sp3雜化,
故答案為:5; ;sp3;
;sp3;
(2)同一周期元素的第一電離能隨著原子序數(shù)的增大而呈增大趨勢,但第IIA族、第VA族元素的第一電離能大于相鄰元素的,所以它們的第一電離能順序:B<C<O<N,
故答案為:B<C<O<N;
(3)①氣態(tài)SeO3分子中中心原子的價層電子對數(shù)為$\frac{6+0}{2}$=3,無孤電子對,所以分子構(gòu)型為平面三角形,
故答案為:平面三角形;
②金屬銅投入氨水或H2O2溶液中均無明顯現(xiàn)象,但投入氨水與H2O2的混合溶液中,則銅片溶解,溶液呈深藍(lán)色,其中過氧化氫為氧化劑,氨與Cu2+形成配離子,兩者相互促進(jìn)使反應(yīng)進(jìn)行,離子方程式可表示為:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
故答案為:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
③在晶胞中,N原子位于頂點,Cu原子位于棱邊中點,該晶胞中N原子個數(shù)=8×$\frac{1}{8}$=1,Cu原子個數(shù)=12×$\frac{1}{4}$=3,晶胞的質(zhì)量為$\frac{64×3+14}{{N}_{A}}$g,晶胞的體積為($\sqrt{2}$apm)3,則ρ=$\frac{\frac{64×3+14}{{N}_{A}}}{(\sqrt{2}a×10{\;}^{-10}cm)}$g•cm-3=$\frac{206}{{{N_A}×2\sqrt{2}×{a^3}}}×{10^{30}}$g/cm3;
故答案為:$\frac{206}{{{N_A}×2\sqrt{2}×{a^3}}}×{10^{30}}$.
點評 本題考查了物質(zhì)結(jié)構(gòu)及其性質(zhì),涉及原子雜化方式的判斷、價電子排布式的書寫、晶胞的計算等知識點,題目綜合性較強,注意根據(jù)價層電子對互斥理論、構(gòu)造原理等知識來分析解答,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學(xué) 來源: 題型:選擇題
| A. | 通式為CnH2n | |
| B. | 可以使酸性高錳酸鉀溶液褪色 | |
| C. | 在光照下可與氯氣發(fā)生加成反應(yīng) | |
| D. | 隨分子中碳原子數(shù)的增加,烷烴的熔沸點升高 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
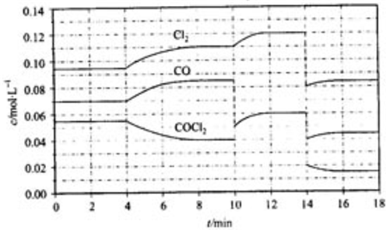
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | v正(N2)=v逆(NH3) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=$\frac{3}{2}$ v逆(NH3) | D. | N2、H2、NH3的體積比為1:3:2 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
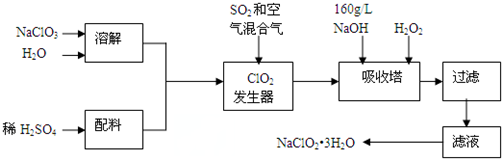
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
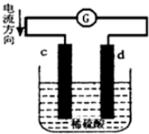 將銅片、鋅片插入500mL2mol/L稀硫酸中組成原電池,c、d為兩個電極.則下列有關(guān)的判斷正確的是(溶液體積變化忽略不計)( )
將銅片、鋅片插入500mL2mol/L稀硫酸中組成原電池,c、d為兩個電極.則下列有關(guān)的判斷正確的是(溶液體積變化忽略不計)( )| A. | c為負(fù)極,其質(zhì)量逐漸減小,發(fā)生還原反應(yīng) | |
| B. | 當(dāng)有0.2mol電子通過電路,正極表明產(chǎn)生氣體2.24L | |
| C. | 電池工作的過程中,溶液中SO42-濃度逐漸減小 | |
| D. | 當(dāng)負(fù)極質(zhì)量減輕32.5g時,燒杯中溶液中H+的濃度為2mol/L |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
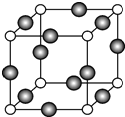 已知A、B、C、D是原子序數(shù)依次增大的四種短周期主族元素,A的周期數(shù)等于其主族序數(shù),B原子的價電子排布為nsnnpn,D是地殼中含量最多的元素.E是第四周期元素且最外層只有2對成對電子,F(xiàn)元素與Cr元素位于同一周期的副族元素中且基態(tài)原子的最外層電子數(shù)與Cr原子相同.
已知A、B、C、D是原子序數(shù)依次增大的四種短周期主族元素,A的周期數(shù)等于其主族序數(shù),B原子的價電子排布為nsnnpn,D是地殼中含量最多的元素.E是第四周期元素且最外層只有2對成對電子,F(xiàn)元素與Cr元素位于同一周期的副族元素中且基態(tài)原子的最外層電子數(shù)與Cr原子相同. .
.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
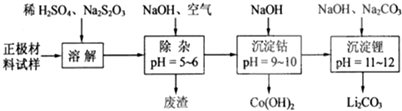
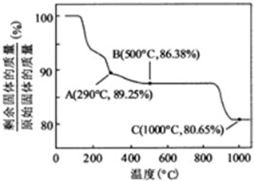
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 純堿、汽油去除油污的原理相同 | |
| B. | 銅的金屬活動性比鋁弱,可用銅罐代替鋁罐貯運濃硝酸 | |
| C. | 鐵表面鍍銅時,銅與電源的正極相連,鐵與電源的負(fù)極相連 | |
| D. | 分餾、蒸餾、煤的液化都是物理變化,干餾、裂化、裂解都是化學(xué)變化 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com