
氯氣在科技、生產中應用廣泛。
(1)工業上常用熟石灰和氯氣反應制取漂白粉,化學方程式是 。
(2)實驗室用MnO2與濃鹽酸反應制取氯氣的原理如下:MnO2 + 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①若制取11.2 L Cl2(標準狀況),則最少應加入MnO2的質量為______g。
②用平衡移動原理解釋可用排飽和食鹽水法收集氯氣的原因 。(結合必要的化學用語及文字回答)
③制備氯氣時,可用NaOH溶液吸收尾氣,下列試劑也可用于吸收氯氣的是____(填字母)。
a. KI溶液 b. FeCl2溶液 c. KCl溶液
寫出你選擇的吸收試劑與Cl2反應的離子方程式:_______。
④也可用濃氨水吸收氯氣,同時生成一種無污染的氣體,反應的化學方程式是_______。
(1)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(2)①43.5;②Cl2溶于水與水反應,Cl2+H2O HClO+HCl,飽和的食鹽水中存在大量的Cl-,平衡向左移動,使Cl2的溶解度減小,所以,可用排飽和食鹽水法收集Cl2。③ab 根據氧化還原反應離子方程式為: Cl2+2I-=2 Cl-+I2、Cl2+2Fe2+= 2Fe3++2Cl-;④3Cl2+8NH3=6NH4Cl+N2(或3Cl2+2NH3=6HCl+N2或寫成一水合氨也行)。
HClO+HCl,飽和的食鹽水中存在大量的Cl-,平衡向左移動,使Cl2的溶解度減小,所以,可用排飽和食鹽水法收集Cl2。③ab 根據氧化還原反應離子方程式為: Cl2+2I-=2 Cl-+I2、Cl2+2Fe2+= 2Fe3++2Cl-;④3Cl2+8NH3=6NH4Cl+N2(或3Cl2+2NH3=6HCl+N2或寫成一水合氨也行)。
解析試題分析:
(1)工業上用熟石灰和氯氣反應制取漂白粉的化學方程式為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)①設MnO2的質量為X
MnO2 + 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
87g 22.4L
X 11.2L
X=43.5g
②Cl2在水溶液中存在:Cl2+H2O HClO+HCl,飽和的食鹽水中存在大量的Cl-,抑制了氯氣的溶解,使化學平衡左移,氯氣的溶解度減小。③Cl2+2I-=2 Cl-+I2、Cl2+2Fe2+= 2Fe3++2Cl- ④氯氣有強化性、氨氣有還原性,二者發生氧化還原反應,化學方程式為3Cl2+8NH3=6NH4Cl+N2,或3Cl2+2NH3=6HCl+N2。
HClO+HCl,飽和的食鹽水中存在大量的Cl-,抑制了氯氣的溶解,使化學平衡左移,氯氣的溶解度減小。③Cl2+2I-=2 Cl-+I2、Cl2+2Fe2+= 2Fe3++2Cl- ④氯氣有強化性、氨氣有還原性,二者發生氧化還原反應,化學方程式為3Cl2+8NH3=6NH4Cl+N2,或3Cl2+2NH3=6HCl+N2。
考點:考查氯氣的化學性質及制取、化學計算。


科目:高中化學 來源: 題型:填空題
白玉的化學式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.l0g白玉粉末灼燒至恒重,固體減少了0.18g,則白玉的摩爾質量為______。
(2)另取4.05g白玉粉末加入l mol/L的鹽酸l00mL中充分溶解,最終得不溶氧化物2. 40g.過濾,將濾液和洗滌液合并后往其中加入足量的鐵屑,得到氣體336mL(標準狀況下).則
①p=_________;
②白玉的化學式(用氧化物的形式)表示為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
請回答下列問題:
(1)制備硅半導體材料必須先得到高純硅。三氯甲硅烷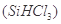 還原法是當前制備高純硅的主要方法,生產過程示意圖如下:
還原法是當前制備高純硅的主要方法,生產過程示意圖如下: 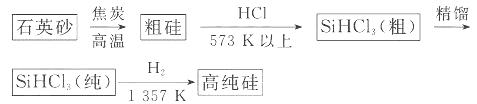
①寫出由純 制備高純硅的化學方程式: ____________________________________。
制備高純硅的化學方程式: ____________________________________。
②整個制備過程必須嚴格控制無水無氧。 遇水劇烈反應生成
遇水劇烈反應生成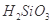 、HCl和另一種物質,配平后的化學反應方程式為___________________________;
、HCl和另一種物質,配平后的化學反應方程式為___________________________;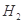 還原
還原 過程中若混入
過程中若混入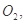 可能引起的后果是____________________________________。
可能引起的后果是____________________________________。
(2)下列有關硅材料的說法正確的是_________ (填字母)。
| A.碳化硅化學性質穩定,可用于生產耐高溫水泥 |
| B.氮化硅硬度大、熔點高,可用于制作高溫陶瓷和軸承 |
| C.高純度的二氧化硅可用于制造高性能通訊材料——光導纖維 |
| D.普通玻璃是由純堿、石灰石和石英砂制成的,其熔點很高 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下圖表示在沒有通風櫥的條件下制備氯氣時設計的裝置,圖中a、b是可控制的彈簧鐵夾。(氯氣在飽和氯化鈉溶液中的溶解度較小。)
(1)儀器A的名稱是 ;水槽中應盛放的是 ;燒杯中盛放的是 ;燒瓶中反應的化學方程式 ;
在收集氯氣時,應打開 關閉 (填a, b)當氯氣收集完畢,尾氣處理時燒杯中發生反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
如圖是現今常規生產發煙硫酸和硫酸的流程圖: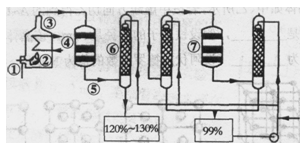
(1)在④處二氧化硫被氧化成三氧化硫,④的設備名稱是 .該處發生反應的方程式為 .為提高三氧化硫的產率,該處應采用 (填“等溫過程”或“絕熱過程”)為宜.
(2)在⑦處進行二次催化處理的原因是 .
(3)⑤處氣體混合物主要是氮氣和三氧化硫.此時氣體經過⑥后不立即進入⑦是因為: .
(4)20%的發煙硫酸(SO3的質量分數為20%)1噸需加水 噸(保留2位有效數字)才能配制成98%的成品硫酸.
(5)在②處發生1500℃的“不完全燃燒”,即先混入少量干燥空氣,然后在③處于700℃下再繼續燃燒.試簡述這種燃燒方式對環境保護是有利的原因 .
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某化學興趣小組的同學為進行物質性質的探究,用維持燒瓶內壓強與分液漏斗內壓強相等,使液體能順利滴下
下圖所示裝置進行實驗。請回答下列問題:(加熱及固定裝置已略去)
(1)裝置A中反應的化學方程式為
(2)裝置C 中的試劑是 ( 填序號).
A.氫氧化鈉溶液 B. 酸性高錳酸鉀溶液 C.亞硫酸氫鈉溶液
發生反應的離子方程式為 ,其說明了SO2具有 ,該實驗操作的名稱是 。
(3)在上述實驗中,能說明碳的非金屬性比硅強的實驗現象是
(4)B中的溶液無明顯現象,當滴加氯水時有白色沉淀,寫出SO2表現還原性并生成白色沉淀的總離子方程式為
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
金剛石SiC具有優良的耐磨、耐腐蝕特性,應用廣泛.
(1)碳與同周期元素Q的單質化合僅能生成兩種常見氣態化合物,其中一種化合物H為非極性分子,碳元素在周期表中的位置是,Q是,R的電子式為.
(2)一定條件下,Na還原CCl4可制備金剛石,反應結束冷卻至室溫后,回收CCl4的實驗操作名稱為,除去粗產品中少量鈉的試劑為.
(3)碳還原制SiC,其粗產品中雜質為Si和SiO2.先將20.0g 粗產品加入到過量的NaOH溶液中充分反應,收集到0.1mol氫氣,過濾得SiC固體11.4g,濾液稀釋到1L,生成氫氣的離子方程式為,硅酸鈉的物質的量濃度為
粗產品加入到過量的NaOH溶液中充分反應,收集到0.1mol氫氣,過濾得SiC固體11.4g,濾液稀釋到1L,生成氫氣的離子方程式為,硅酸鈉的物質的量濃度為
(4)下列敘述正確的有(填序號),ks5u
①Na還原CCl4的反應、Cl2與H2O的反應均是置換反應②水晶、干冰熔化時克服粒子間作用力的類型相同③Na2SiO3溶液與SO3的反應可用于推斷Si與S的非金屬性強弱
④鈉、鋰分別在空氣中燃燒,生成的氧化物中陰陽離子數目比均為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫化氫(H2S)是一種具有臭雞蛋氣味的無色氣體,有劇毒;存在于多種生產過程以及自然界中。在人體的很多生理過程中也起著重要作用。
| 資料:① H2S可溶于水(約1:2),其水溶液為二元弱酸。 ② H2S可與許多金屬離子反應生成沉淀。 ③ H2S在空氣中燃燒,火焰呈淡藍色。 |
| | 實驗操作 | 實驗現象 |
| 實驗1 | 將等濃度的Na2S和Na2SO3溶液按體積比2∶1混合 | 無明顯現象 |
| 實驗2 | 將H2S通入Na2SO3溶液中 | 未見明顯沉淀,再加入少量稀硫酸,立即產生大量淺黃色沉淀 |
| 實驗3 | 將SO2通入Na2S溶液中 | 有淺黃色沉淀產生 |
 |  |  |  |
| A | B | C | D |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
氨氣是化學工業上應用非常廣泛的物質。下面僅是它在兩方面的重要用途。
“侯氏制堿法”的發明為振興中國化工工業做出了重要貢獻。制堿法的第一步反應是向飽和氨化鹽水中通入二氧化碳,該反應可表示為:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
現在45℃時,取117g食鹽配制成飽和溶液,向其中通入適量氨氣后,再向其中通入二氧化碳,使反應進行完全。試計算并回答下列問題(計算結果取三位有效數字)(有關物質的溶解度數據如表,單位:g/100g水)。
| | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
 (4)請討論b∕a的取值范圍及與之對應的溶液的溶質及其物質的量,將結果填于下表中:
(4)請討論b∕a的取值范圍及與之對應的溶液的溶質及其物質的量,將結果填于下表中:| b∕a的取值范圍 | 溶質 | 溶質物質的量 |
| | | |
 | —— | —— |
| | | |
| | | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com