
鋅與不同濃度的硝酸反應,HNO3可以被還原成不同價態的產物。下列化學反應中參加反應的鋅與被還原的HNO3的物質的量的關系符合圖1-12(x表示被還原的HNO3的物質的量,y表示耗去Zn的物質的量)的是( )
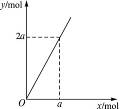
圖1-12
A.3Zn+8HNO3(稀)====3Zn(NO3)2+2NO↑+4H2O
B.4Zn+10HNO3(極稀) ====4Zn(NO3)2+NH4NO3+3H2O
C.4Zn+10HNO3(很稀) ====4Zn(NO3)2+N2O↑+5H2O
D.Zn+4HNO3(濃) ====Zn(NO3)2+NO2↑+2H2O
 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:閱讀理解
| 硝酸 | 硝酸濃度大于10mol/L | 硝酸濃度為6.6~10mol/L、加熱 | 硝酸濃度為6.6~10mol/L |
| 還原產物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸濃度為0.1~6.6mol/L、加熱 | 硝酸濃度0.1~6.6mol/L | 硝酸濃度0.1mol/L |
| 還原產物 | NO | NO2、N2 | NH4NO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 金屬腐蝕造成很大的經濟損失,甚至超過自然災害,其中鋼鐵銹蝕最為嚴重,尋求防止鋼鐵腐蝕的方法意義重大.
金屬腐蝕造成很大的經濟損失,甚至超過自然災害,其中鋼鐵銹蝕最為嚴重,尋求防止鋼鐵腐蝕的方法意義重大.| 1 |
| 5 |
| 2 |
| 9 |
| 1 |
| 4 |
| 1 |
| 3 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
金屬腐蝕造成很大的經濟損失,甚至超過自然災害,其中鋼鐵銹蝕最為嚴重,尋求防止鋼鐵腐蝕的方法意義重大。
⑴鋼鐵的表面發藍、發黑處理是常用的防腐方法。下列反應是主要反應之一。
請配平化學方程式:
口Na2FeO2+ 口NaNO2+ 口 =口 NaFeO2+ 口NH3↑+ 口NaOH
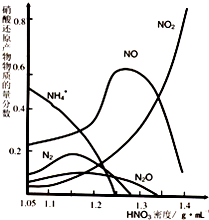
⑵鋼鐵的“鈍化”處理也能達到防腐目的,經冷、濃HNO3處理后,其表面有一層致密氧化物保護膜,但是加熱或在稀HNO3中就不能“鈍化”。不同濃度的HNO3與鐵反應的還原產物很復雜,其分布曲線如圖。

①圖示可知,密度大于1.35 g?mL-1的硝酸與鐵反應時,其還原產物主要是 ;密度為1.05g?mL-1 的硝酸與鐵反應時,其最多的還原產物是 ;分析HNO3與鐵反應的規律是 。
②工業上一般不用冷濃硝酸進行鐵表面處理,其可能的原因是: 。
⑶金屬 (M) 的腐蝕是因為發生反應: M-ne-→Mn+。鋼鐵除了上述表面處理的方法外,下列方法也能起到防腐作用的是 (填字母編號)。
A.在鐵中摻入鉻、鎳等金屬,改變其內部結構,制成不銹鋼
B.在鐵制品表面鍍鋅
C.提高鐵中含碳量,制成生鐵
D.將水庫鐵閘門與直流電源的負極相連
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
查看答案和解析>>
科目:高中化學 來源: 題型:
較活潑的金屬鋅與不同濃度的硝酸反應時,可得到不同價態的還原產物,如果其反應的鋅和被還原的硝酸的物質的量之比為4:1,則硝酸的還原產物可能是
A.NO2 B.NO C.N2O D.NH4NO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com