
 已知A、B、C、D、E、F均為前四周期元素.A元素的原子價電子排布為ns2np2,B元素的最外層電子數是其電子層數的3倍,C元素原子核外的M層中只有2對成對電子.D元素原子的M電子層的P能級中有3個未成對電子.B離子與E離子具有相同的電子層結構,可形成E2B2、E2B型化合物.F元素位于元素周期表的ds區,其原子與E原子具有相同的最外層電子數.
已知A、B、C、D、E、F均為前四周期元素.A元素的原子價電子排布為ns2np2,B元素的最外層電子數是其電子層數的3倍,C元素原子核外的M層中只有2對成對電子.D元素原子的M電子層的P能級中有3個未成對電子.B離子與E離子具有相同的電子層結構,可形成E2B2、E2B型化合物.F元素位于元素周期表的ds區,其原子與E原子具有相同的最外層電子數.| 電離能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
分析 A、B、C、D、E、F均為前四周期元素,B元素的最外層電子數是其電子層數的3倍,B為O元素;B離子與E離子具有相同的電子層結構,離子含有電子數為10,可形成E2B2、E2B型化合物,故E為Na元素;C元素原子核外的M層中只有2對成對電子,則C元素價電子排布為3s23p4,故C為S元素;D元素原子的M電子層的P能級中有3個未成對電子,則D元素價電子排布為3s23p3,故D為P元素;F元素位于元素周期表的ds區,其原子與E原子具有相同的最外層電子數,最外層電子數為1,故F的價電子排布為3d104s1,F是Cu元素,A元素的原子價電子排布為ns2np2,屬于第ⅣA族.
(1)根據能量最低原理書寫Cu原子核外電子排布;
(2)根據最后電子填充的能級確定其在周期表中的區域;
(3)A元素的原子價電子排布為ns2np2,當n=2時,A是C元素,與氫元素形成的相對分子質量為26的分子為乙炔;
(4)A元素的原子價電子排布為ns2np2,當n=3時,A是Si元素,硅和氧形成的晶體是二氧化硅晶體,屬于原子晶體;Si晶體中每個Si原子與另外4個Si原子形成正四面體結構,每個Si-Si鍵為Si原子提供$\frac{1}{2}$,根據均攤法計算Si原子所處共價鍵數目;
(5)ABn型分子A原子孤對電子數=$\frac{1}{2}$(a-xb),a為A原子價電子數目,x為A原子結合原子數,b為B原子最多結合電子數目;
P原子價層電子對數=σ數+孤對電子數,結合P原子的孤對電子,確定PCl3分子的空間構型;
(6)根據均攤法計算晶胞中Cu原子、O原子數目,據此確定化學式;根據晶胞中原子數目計算晶胞質量,根據V=$\frac{m}{ρ}$計算晶胞體積;
(7)相同能層電子能量相差不大,不能能層電子能量相差較大,故失去不同能層電子時電離能會發生突躍,由表中數據可知,失去第6個電子時,電離能劇增,故該元素最外層電子數為5.
解答 解:A、B、C、D、E、F均為前四周期元素,B元素的最外層電子數是其電子層數的3倍,B為O元素;B離子與E離子具有相同的電子層結構,離子含有電子數為10,可形成E2B2、E2B型化合物,故E為Na元素;C元素原子核外的M層中只有2對成對電子,則C元素價電子排布為3s23p4,故C為S元素;D元素原子的M電子層的P能級中有3個未成對電子,則D元素價電子排布為3s23p3,故D為P元素;F元素位于元素周期表的ds區,其原子與E原子具有相同的最外層電子數,最外層電子數為1,故F的價電子排布為3d104s1,F是Cu元素,A元素的原子價電子排布為ns2np2,屬于第ⅣA族.
(1)①由上述分析可知,B為氧元素;
②F為Cu原子,核外電子數為29,根據能量最低原理,核外的價電子排布為3d104s1,
故答案為:氧;3d104s1;
(2)①C為S元素,外圍電子排布為3s23p4,電子最后填充p能級,屬于p區元素,
②E為Na元素,外圍電子排布式為3s1,電子最后填充s能級,屬于s區元素,
故答案為:p;s;
(3)A元素的原子價電子排布為ns2np2,當n=2時,A是C元素,與氫元素形成的相對分子質量為26的分子為乙炔,其結構式為H-C≡C-H,屬于直線型對稱結構,分子中正負電荷重心重合,為非極性分子,乙炔分子中C-H單鍵為個σ鍵,-C≡C-三鍵含有1個σ鍵、2個π鍵,故乙炔分子中共含有3σ鍵、2個π鍵,
故答案為:非極性;3;2;
(4)A元素的原子價電子排布為ns2np2,當n=3時,A是Si元素,硅和氧形成的晶體是二氧化硅晶體,屬于原子晶體;Si晶體中每個Si原子與另外4個Si原子形成正四面體結構,Si原子成4個σ鍵、不含孤對電子,采取sp3雜化,每個Si-Si鍵為Si原子提供$\frac{1}{2}$,即每個Si原子成共價鍵數目為4×$\frac{1}{2}$=2,故硅晶體中Si原子與Si-Si鍵數目之比=1:2,
故答案為:原子;sp3;1:2;
(5)PCl3分子中,中心原子P含有孤對電子對數=$\frac{5-1×3}{2}$=1,PCl3分子中S原子價層電子對數=3+1=4,故其空間構型為三角錐形,
故答案為:1;三角錐形;
(6)由晶胞結構可知,晶胞中Cu原子數目=4、O原子數目=1+8×$\frac{1}{8}$=2,故該氧化物的化學式為Cu2O,晶胞質量為$\frac{4×64+16×2}{{N}_{A}}$g,該晶體的密度為ag•cm-3,則晶胞的體積為$\frac{4×64+16×2}{{N}_{A}}$g÷ag•cm-3=$\frac{288}{a{N}_{A}}$cm3,
故答案為:Cu2O;$\frac{288}{a{N}_{A}}$;
(7)相同能層電子能量相差不大,不能能層電子能量相差較大,故失去不同能層電子時電離能會發生突躍,由表中數據可知,失去第6個電子時,電離能劇增,故該元素最外層電子數為5,可能為上述P元素,
故答案為:P.
點評 本題考查物質結構與性質,題目比較綜合,涉及結構性質位置關系、核外電子排布、分子結構與性質、價層電子對互斥理論、雜化理論、化學鍵、電離能、晶胞計算等,側重考查主干知識,需要學生具備扎實的基礎知識,難度中等,(4)為易錯點、難點,注意識記中學常見晶體結構.


科目:高中化學 來源: 題型:選擇題
 .如果要合成化合物A,其結構為:
.如果要合成化合物A,其結構為: ,下列說法正確的是( )
,下列說法正確的是( )| A. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 | |
| B. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| C. | 該反應的原理是取代反應 | |
| D. | 化合物A和HBr 按照物質的量1:1加成時,有三種不同的產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題



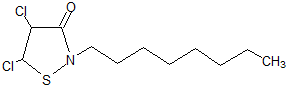 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室蒸餾石油的實驗中,冷凝管的水流方向是上方進水下方出水 | |
| B. | 石油裂解不是生產乙烯的主要方法 | |
| C. | 油脂和石油是同一類有機物 | |
| D. | 從石油分餾得到的汽油,主要由含5-12個碳原子的烷烴組成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開發太陽能、水能、風能、可燃冰等新能源、減少使用煤、石油等化石燃料 | |
| B. | 將煤進行“氣化”和“液化”處理,提高煤的綜合利用效率 | |
| C. | 研究采煤、采油新技術,提高產量以滿足工業生產的快速發展 | |
| D. | 實現資源的“3R”利用觀,即:減少資源消耗(Reduce)、增加資源的重復使用(Reuse)、資源的循環再生(Recycle) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com