
| 物質 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀時的pH范圍 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向該混合溶液中逐滴加入NaOH溶液,最先看到紅褐色沉淀 | |
| B. | 向該混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| C. | 向該混合溶液中加入適量H2O2,并調節pH到3~4后過濾可獲得純凈的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
分析 A、依據圖表分析,鐵離子首先開始沉淀;
B、依據圖表分析,鐵離子首先開始沉淀;
C、混合溶液中加入適量H2O2,亞鐵離子被氧化為亞鐵離子,調節溶液PH=3~4鐵離子沉淀完全;
D、由圖表可知Fe3+在PH=3~4已經完全沉淀;
解答 解:A、依據陽離子沉淀的PH可知加入氫氧化鈉溶液先沉淀的是氫氧化鐵,最先看到的是紅褐色沉淀,故A正確;
B、依據陽離子沉淀的PH可知加入氫氧化鈉溶液先沉淀的是氫氧化鐵,最先看到的是紅褐色沉淀,故B錯誤;
C、混合溶液中加入適量H2O2,亞鐵離子被氧化為亞鐵離子,調節溶液PH=3~4鐵離子沉淀完全,最后溶液中的溶質只有CuSO4溶液,所以過濾可獲得純凈的CuSO4溶液,故C正確;
D、由圖表可知Fe3+在PH=3~4已經完全沉淀,所以PH=5的溶液中Fe3+不能大量存在,故D正確;
故選B.
點評 本題考查了離子沉淀條件的分析判斷,鹽類水解的應用,除雜實驗方法的應用,題目難度中等,側重于考查學生的分析能力和對基礎知識的應用能力.


科目:高中化學 來源: 題型:選擇題
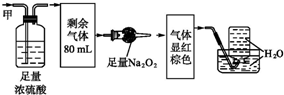
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純堿溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 銅與濃硫酸共熱產生氣體:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 鐵釘在潮濕的空氣中很快被腐蝕:Fe-3e-═Fe3+ | |
| D. | 氨氣遇到氯化氫時產生白煙:NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 50mL鹽酸 | 50mL鹽酸 | 50mL鹽酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(標況) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
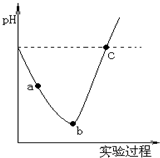 在常溫下,取一定量的蒸餾水,然后將Cl2緩慢通入水中至飽和,再向所得飽和氯水中滴加0.1mol/L的NaOH溶液.整個實驗進程中溶液的pH變化曲線如圖所示,下列敘述正確的是( )
在常溫下,取一定量的蒸餾水,然后將Cl2緩慢通入水中至飽和,再向所得飽和氯水中滴加0.1mol/L的NaOH溶液.整個實驗進程中溶液的pH變化曲線如圖所示,下列敘述正確的是( )| A. | 實驗進程中可用pH試紙測定溶液的pH | |
| B. | 向a點所示溶液中能入SO2,溶液的酸性和漂白性均增強 | |
| C. | 由a點到b點的過程中,溶液中c(H+)/c(ClO-)減小 | |
| D. | c點所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量濃度相同的硫酸氫銨溶液和醋酸銨溶液中,硫酸氫銨中的銨根離子物質的量濃度較小 | |
| B. | 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等濃度的NaCl溶液,有白色沉淀產生,再加入6 mL等濃度的Na2S溶液,溶液中又有黑色沉淀生成,說明Ksp(Ag2S)<Ksp(AgCl) | |
| C. | 物質的量濃度均為0.02 mol/L的弱酸HX及其鹽NaX等體積混合后:c(X-)+c(HX)=0.02 mol/L | |
| D. | 己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含C1-、CrO42-濃度相同的溶液中滴加AgNO3溶液時,首先生成Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1000mL,106g | B. | 1000mL,286g | C. | 950mL,100.7g | D. | 950mL,271.7g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應速率是化學反應進行快慢程度的物理量 | |
| B. | 化學反應速率通常用單位時間內生成或消耗某物質的質量的多少來表示 | |
| C. | 在同一個反應中,可以用反應物或生成物來表示反應速率 | |
| D. | 化學反應速率的常用單位有mol/(L•s)和mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com