
(提前進度)
(1)已知H2O(1)=H2O(g);△H=+44KJ/mol。在25℃、101 kPa下,1g甲醇燃燒生成CO2和氣態水時放熱19.93kJ,則該反應的熱化學方程式應為______。
(2)已知H2的燃燒熱△H=-285.8kJ·mol-1,CO的燃燒熱△H=-282.8 kJ·mol-1。現有CO、H2、CO2組成的混合氣體67.2L(標準狀況),經充分燃燒后放出的總熱量為710.0 kJ,并生成18g液態水,求燃燒前混合氣體中CO的體積分數。
(1)CH3OH(l)+3/2O2(g)=(g)CO2(g)+2H2O(l) △H=-725.76kJ/mol (3分)
(2)50%
【解析】(1)1g甲醇燃燒生成CO2和氣態水時放熱19.93kJ,則1mol甲醇燃燒燃燒非常的熱量是19.93kJ×32=637.76kJ。生成的2mol氣態水變成液態水,又放出44kJ×2=88kJ,所以總共放出的熱量是637.76kJ+88kJ=725.76kJ,所以熱化學方程式為
CH3OH(l)+3/2O2(g)=(g)CO2(g)+2H2O(l) △H=-725.76kJ/mol 。
(2)考查根據方程式進行的有關計算。
(2)標準狀況下n(混合氣體)= =3
mol(1分)
=3
mol(1分)
其中有n(H2)=  =1 mol (2分)
=1 mol (2分)
1mol H2燃燒生成液態水時放熱 =285.8kJ(1分)
=285.8kJ(1分)
CO燃燒時放出的熱量為710.0kJ-285.8kJ=424.2kJ(CO2不燃燒)(1分)
故n(CO)=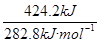 =1.5mol(1分)
=1.5mol(1分)
CO的體積分數為 ×100%=50% (1分)
×100%=50% (1分)


科目:高中化學 來源:四川省廣元中學2009-2010學年高二下學期開學考試化學試題 題型:058
(教學進度沒有提前學校的學生做)某學習小組用如圖裝置測定鋁鎂合金中鋁的相對原子質量.

(1)A的儀器名稱為________,A中試劑為________.
(2)檢查裝置不漏氣后將藥品和水裝入各儀器中,連接好裝置后,需進行的操作還有:①記錄反應前C的液面位置;②將B中剩余固體過濾、洗滌、干燥、稱重;③待B中不再有氣體產生并恢復至室溫后,記錄C的液面位置;④由A向B中滴加足量試劑.上述操作的順序是________(填序號).
上述操作③在記錄C的液面位置時,除視線平視外,還應________.
(3)B中發生反應的化學方程式為________.
(4)若實驗用鋁鎂合金的質量為a g,測得氫氣體積為b mL(已換算為標準狀況),B中剩余固體質量為c g,則鋁的相對原子質量為________.
(5)實驗過程中,若未洗滌過濾所得的不溶物,則測得鋁相對原子質量將________(填“偏大”、“偏小”或“不受影響”)
(6)有同學提出應在裝置(Ⅰ)(Ⅱ)之間添加一個裝有濃H2SO4的洗氣瓶,你認為有必要嗎?________(填“有”或“無”)
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江西省吉安市高一下學期期末教學質量評價化學試卷(帶解析) 題型:計算題
(提前進度)
(1)已知H2O(1)=H2O(g);△H=+44KJ/mol。在25℃、101 kPa下,1g甲醇燃燒生成CO2和氣態水時放熱19.93kJ,則該反應的熱化學方程式應為______。
(2)已知H2的燃燒熱△H=-285.8kJ·mol-1,CO的燃燒熱△H=-282.8 kJ·mol-1。現有CO、H2、CO2組成的混合氣體67.2L(標準狀況),經充分燃燒后放出的總熱量為710.0 kJ,并生成18g液態水,求燃燒前混合氣體中CO的體積分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com