
【題目】中科院大連化學物理研究所設計了一種新型Na-Fe3O4/HZSM-5多功能復合催化劑,成功實現了CO2直接加氫制取高辛烷值汽油,該研究成果被評價為“CO2催化轉化領域的突破性進展”。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
則8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ΔH=___kJ·mol-1。
(2)氨硼烷(NH3BH3)是儲氫量最高的材料之一,氨硼烷還可作燃料電池,其工作原理如圖1所示。氨硼烷電池工作時正極的電極反應式為__________。
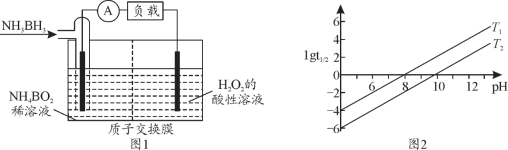
(3)常見含硼的化合物有NaBH4、NaBO2,已知NaBH4溶于水生成NaBO2、H2,寫出其化學方程式_______。![]() 為NaBH4反應的半衰期(反應一半所需要的時間,單位為min)。lgt1/2隨pH和溫度的變化如圖2所示,則T1______T2(填“>”或“<”)。
為NaBH4反應的半衰期(反應一半所需要的時間,單位為min)。lgt1/2隨pH和溫度的變化如圖2所示,則T1______T2(填“>”或“<”)。
(4)燃油汽車尾氣含有大量的NO,在活化后的V2O5催化作用下,氨氣將NO還原成N2的一種反應歷程如圖3所示。
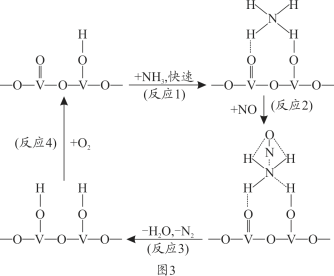
根據圖寫出總反應的化學方程式_______________。
【答案】-1627 2H++H2O2+2e-=2H2O NaBH4+2H2O=NaBO2+4H2↑ < 4NO+4NH3+O2![]() 4N2+6H2O
4N2+6H2O
【解析】
(1)根據蓋斯定律,將已知的熱化學方程式疊加,可得待求反應的熱化學方程式,即得反應熱;
(2)氨硼烷(NH3BH3)電池工作時的總反應為:NH3BH3+3H2O2═NH4BO2+4H2O,左側NH3BH3為負極、失電子、發生氧化反應,電極反應式為NH3BH3+2H2O-6e-=NH4++BO2-+6H+,右側H2O2得到電子、發生還原反應,所在電極為正極,電極反應式為3H2O2+6H++6e-=6H2O,據此解答;
(3)NaBH4溶于水生成NaBO2、H2,結合溶液的pH與半衰期的關系判斷溫度的高低;
(4)用V2O5作催化劑,NH3可將NO還原成N2,結合反應歷程圖可知反應物還有氧氣,生成物為N2和H2O,配平即得反應方程式。
(1)①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
②C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
根據蓋斯定律①×![]() -②,整理可得:8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) △H=(-571.6 kJ/mol)×
-②,整理可得:8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) △H=(-571.6 kJ/mol)×![]() -(-5518kJ/mol)=-1627kJ/mol;
-(-5518kJ/mol)=-1627kJ/mol;
(2)氨硼烷(NH3BH3)電池工作時的總反應為:NH3BH3+3H2O2═NH4BO2+4H2O,右側H2O2得到電子、發生還原反應,所在電極為正極,電極反應式為3H2O2+6H++6e-=6H2O;
(3)NaBH4可水解放出氫氣,反應方程式為:NaBH4+2H2O=NaBO2+4H2↑,在酸性條件下,NaBH4不能穩定性存在,NaBH4和酸反應生成硼酸和氫氣,反應的離子方程式為:BH4-+H++3H2O=H3BO3+4H2↑。水解反應為吸熱反應,升溫促進水解,使半衰期縮短,故T1<T2;
(4)用V2O5作催化劑,NH3可將NO還原成N2,結合反應歷程圖可知反應物還有氧氣,生成物為N2和H2O,配平即得反應方程式為4NO+4NH3+O2![]() 4N2+6H2O。
4N2+6H2O。


科目:高中化學 來源: 題型:
【題目】PCl3和PCl5都是重要的化工原料。將2.0 mol PCl3(g)和1.0 mol Cl2(g)充入體積不變的1L密閉容器中,在一定條件下發生下述反應:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,平衡時PCl5為0.4 mol,如果此時移走1.0 mol PCl3和0.5 molCl2,在相同條件下再達平衡時PCl5的物質的量是
PCl5(g) △H<0,平衡時PCl5為0.4 mol,如果此時移走1.0 mol PCl3和0.5 molCl2,在相同條件下再達平衡時PCl5的物質的量是
A.0.4molB.0.2molC.小于0.2molD.大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源危機當前是一個全球性問題,“開源節流”是應對能源危機的重要舉措。
(1)下列做法有助于能源“開源節流”的是__(填字母)。
A.大力發展農村沼氣,將廢棄的秸稈轉化為清潔高效的能源
B.大力開采煤、石油和天然氣以滿足人們日益增長的能源需求
C.開發太陽能、水能、風能、地熱能等新能源,不使用煤、石油等化石燃料
D.減少資源消耗,增加資源的重復使用、資源的循環再生
(2)金剛石和石墨均為碳的同素異形體,它們在氧氣不足時燃燒生成一氧化碳,在氧氣充足時充分燃燒生成二氧化碳,反應中放出的熱量如圖所示。
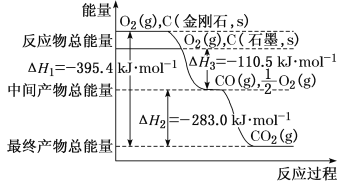
①在通常狀況下,金剛石和石墨相比較,__(填“金剛石”或“石墨”)更穩定,石墨的燃燒熱為ΔH=___。
②12g石墨在一定量空氣中燃燒,生成氣體36g,該過程放出的熱量為__kJ。
(3)已知:N2、O2分子中化學鍵的鍵能分別是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g)ΔH=+180.0kJ·mol-1。NO分子中化學鍵的鍵能為__。
(4)綜合上述有關信息,請寫出用CO除去NO的熱化學方程式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖所示裝置進行Fe與水蒸氣反應的實驗,下列有關說法不正確的是

A. 裝置A的作用是為實驗提供持續不斷的水蒸氣
B. 裝置B中反應的化學方程式是2Fe+3H2O![]() Fe2O3+3H2↑
Fe2O3+3H2↑
C. 裝置C中加入的固體干燥劑可能是堿石灰
D. 點燃D處的氣體前必須檢驗氣體的純度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組用如圖所示裝置驗證鹵素單質氧化性的相對強弱。下列說法不正確的是( )
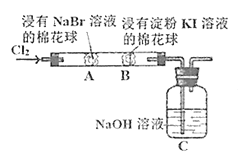
A.A處棉花球變成黃色,說明Cl2的氧化性比Br2強
B.B處棉花球變成藍色,說明Br2的氧化性比I2強
C.A處發生反應的離子方程式為:Cl2+2Br-=2Cl-+Br2
D.C裝置中與NaOH溶液反應的離子方程式為:Cl2+2OH-=ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某班同學用如下實驗探究Fe2+、Fe3+的性質。回答下列問題:
(1)分別取一定量硫酸鐵、硫酸亞鐵固體,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液時需加入少量鐵屑,其目的是__。
(2)甲組同學取2mLFeSO4溶液,加入幾滴氯水,再加入1滴KSCN溶液,溶液變紅,說明Cl2可將Fe2+氧化。FeSO4溶液與氯水反應的離子方程式為___。
(3)乙組同學認為甲組的實驗不夠嚴謹,該組同學在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入幾滴氯水和1滴KSCN溶液,溶液變紅,煤油的作用是__。
(4)丙組同學研究pH對FeSO4穩定性的影響,得到如圖所示結果,增強Fe2+穩定性的措施為__。(寫出一條即可)
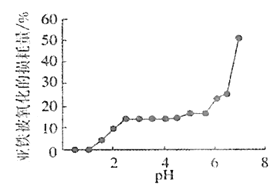
(5)丁組同學為了探究Fe2(SO4)3與Cu的反應,做了如圖所示實驗:
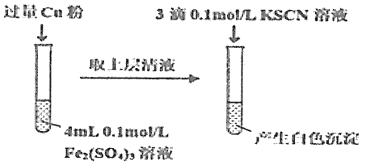
①Fe3+與Cu反應的離子方程式為__。
②為了探究白色沉淀產生的原因,同學們查閱資料得知:
i.CuSCN是難溶于水的白色固體;
ii.SCN的化學性質與I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填寫實驗方案:
實驗方案 | 現象 |
步驟1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 無明顯現象 |
步驟2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 產生白色沉淀 |
Cu2+與SCN-反應的離子方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列中心原子的雜化軌道類型和分子幾何構型不正確的是( )
A.PCl3中 P原子sp3雜化,為三角錐形
B.BCl3中B原子sp2雜化,為平面三角形
C.CS2中C原子sp雜化,為直線形
D.H2S中S原子sp雜化,為直線形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生活中的消毒劑酒精、含氯消毒劑、過氧乙酸等均可有效滅活病毒。病毒對紫外線和熱敏感。下列有關說法正確的是
A.84消毒液的主要有效成分是![]()
B.過氧乙酸![]() 可作為消毒劑,與苯酚混合使用殺菌能力更強
可作為消毒劑,與苯酚混合使用殺菌能力更強
C.加熱能殺死病毒是因為蛋白質受熱變性
D.聚丙烯樹脂是生產無紡布口罩的初始原料之一,聚丙烯可以使酸性高錳酸鉀溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列說法或表示式正確的是( )
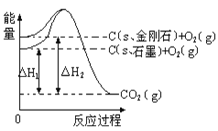
A. C(s、石墨)==C(s、金剛石)△H=+1.9kJmol-1
B. 石墨和金剛石的轉化是物理變化
C. 金剛石的穩定性強于石墨
D. 1 mol石墨的總鍵能比1 mol金剛石的總鍵能小1.9 kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com