
(1)
在一定體積的密閉容器中,進行如下化學反應,CO2(g)+H2(g)
①該反應的化學平衡常數的表達式K=________,由上表數據可得,該反應為________反應.(填“吸熱”或“放熱”)
②800℃,固定容器的密閉容器中,放入混合物,其始濃度為c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,則反應開始時,H2O的消耗速率比生成速率________(填“大”、“小”或“不能確定”)
③830℃,在1 L的固定容器的密閉容器中放入2 mol CO2和1 mol H2,平衡后CO2的轉化率為________.
(2)目前工業上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,在500℃下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+
CH3OH(g)+

①平衡時CH3OH的體積分數w為________.
②現在溫度、容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下.下列說法正確的是________

A.2C1>C3
B.x+y=49.0
C.2P2<P3
D.(a1+a3)<1
E.2P1>P3
F.a1=a2
③
在一個裝有可移動活塞的容器中進行上述反應:CO2(g)+3H2(g) 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
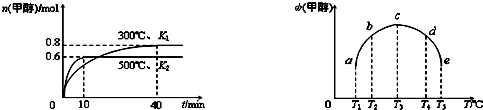
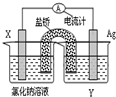
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源:2013年河南省開封市高考化學一模試卷(解析版) 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:
研究和開發CO2 和CO的創新利用是環境保護和資源利用
的雙贏的課題。
I.CO可用于合成甲醇。在壓強為0.1Mpa條件下,在體積為bL的密
閉容器中充入amolCO和2amolH2,在催化劑作用下合成甲醇;
![]() 平衡時CO的轉化率與溫度,壓強的關系如下圖:
平衡時CO的轉化率與溫度,壓強的關系如下圖:
 (1)100℃時,該反應的平衡常數:
(1)100℃時,該反應的平衡常數:
K= ;(用a、b的代數式表
示)。若一個可逆反應的平衡常數K值
很 大,對此反應的說法正確的是:
(填序號)
A.該反應使用催化劑意義不大;
B.該反應發生將在很短時間內完成;
C. 該反應達到平衡時至少有一種反應物
百分含量很小;
D.反應物的轉化率一定高:
(2)在溫度和容積不變的情況下,再向平衡體系中充入amolCO,2amolH2,達到平衡時
CO轉化率 (填“增大”,“不變”或“減小”,下同)平衡常數: 。
(3)在某溫度下,向一容積不變的密閉容器中充入2.5molCO,7.5molH2,反應生成CH3OH
(g),達到平衡時,CO轉化率為90%,此時容器內壓強為開始時的壓強 倍。
11.某溫度條件下,若將CO2(g)和H2(g)以體積比1:4混合,在適當壓強和催化劑
作用下可制得甲烷,己知:
![]()
則![]() 和
和![]() 反應生成液態水的熱化學方程式為:
反應生成液態水的熱化學方程式為:
。
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)反應前混合氣體中N2和H2的體積比。
(2)平衡混合氣體中NH3和H2的物質的量。
(3)達到平衡時N2的轉化率。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com