
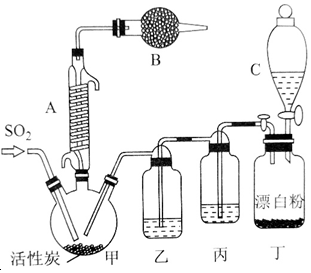
 有關信息如下:硫酰氯通常條件下為無色液體,熔點為-54.1℃,沸點為69.1℃,在潮濕空氣中“發煙”;100℃以上開始分解,生成二氧化硫和氯氣,長期放置也會發生分解.回答下列問題:
有關信息如下:硫酰氯通常條件下為無色液體,熔點為-54.1℃,沸點為69.1℃,在潮濕空氣中“發煙”;100℃以上開始分解,生成二氧化硫和氯氣,長期放置也會發生分解.回答下列問題:分析 (1)根據儀器的構造可判斷裝置甲中儀器A的名稱;該反應需要催化劑,則甲中活性炭的作用是催化劑;硫酰氯在潮濕空氣中“發煙”,而空氣中含有水蒸氣;
(2)裝置丁是提供氯氣的,在酸性溶液中漂白粉能氧化氯離子生成氯氣;
(3)氯磺酸(C1SO3H)加熱分解,也能制得硫酰氯與另外一種物質,根據原子守恒可知另一種生成物是硫酸;硫酰氯通常條件下為無色液體,熔點為-54.1℃,沸點為69.1℃,而硫酸沸點高;
(4)生成的氯氣中含有氯化氫;氯氣和二氧化硫可能發生反應生成硫酸;
(5)由于硫酰氯通常條件下為無色液體,熔點為-54.1℃,沸點為69.1℃,在潮濕空氣中“發煙”;100℃以上開始分解,生成二氧化硫和氯氣,長期放置也會發生分解.
解答 解:(1)根據儀器的構造可判斷裝置甲中儀器A的名稱為冷凝管或蛇形冷凝管或環形冷凝管;該反應需要催化劑,則甲中活性炭的作用是催化劑;硫酰氯在潮濕空氣中“發煙”,而空氣中含有水蒸氣,則裝置B的作用是吸收空氣中水蒸氣,且吸收未反應的二氧化硫與氯氣,防止污染空氣,
故答案為:冷凝管或蛇形冷凝管或環形冷凝管;催化劑; 吸收空氣中水蒸氣,且吸收未反應的二氧化硫與氯氣,防止污染空氣;
(2)裝置丁是提供氯氣的,在酸性溶液中漂白粉能氧化氯離子生成氯氣,則裝置丁中發生反應的離子方程式為Cl-+ClO-+2H+=Cl2↑+H2O,
故答案為:Cl-+ClO-+2H+=Cl2↑+H2O;
(3)氯磺酸(ClSO3H)加熱分解,也能制得硫酰氯與另外一種物質,根據原子守恒可知另一種生成物是硫酸,因此該反應的化學方程式為2ClSO3H $\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;硫酰氯通常條件下為無色液體,熔點為-54.1℃,沸點為69.1℃,而硫酸沸點高,則分離產物的方法是蒸餾,則C正確,
故答案為:2ClSO3H $\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;C;
(4)生成的氯氣中含有氯化氫,所以裝置丙的作用為除去HCl氣體.氯氣具有強氧化性,能氧化SO2,裝置乙是干燥氯氣的,因此若缺少裝置乙,氯氣和二氧化硫可能發生反應的化學方程式為SO2+Cl2+2H2O=H2SO4+2HCl,故答案為:除去HCl氣體; SO2+Cl2+2H2O=H2SO4+2HCl;
(5)由于硫酰氯通常條件下為無色液體,熔點為-54.1℃,沸點為69.1℃,在潮濕空氣中“發煙”;100℃以上開始分解,生成二氧化硫和氯氣,長期放置也會發生分解,因此為提高本實驗中硫酰氯的產率,在實驗操作中需要注意的事項有①先通冷凝水,再通氣,②控制氣流速率,宜慢不宜快,③若三頸燒瓶發燙,可適當降溫,但不能加熱三頸燒瓶,否則會加速分解,①②③正確,故答案為:①②③.
點評 本題考查制備實驗方案的設計,為高頻考點,把握制備原理、實驗裝置的作用、實驗技能為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②④⑤⑥ | C. | ①②④ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫元素的質量比為5:4 | B. | 任何情況下體積比均為1:1 | ||
| C. | 含有的O2、O3兩分子數之比為1:1 | D. | SO2、SO3兩分子數之比為1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
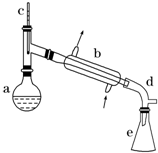 醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:
醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下: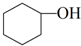 $→_{△}^{濃硫酸}$
$→_{△}^{濃硫酸}$ +H2O
+H2O| 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 溶解性 | |
| 環己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 環己烯 | 82 | 0.810 2 | 83 | 難溶于水 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
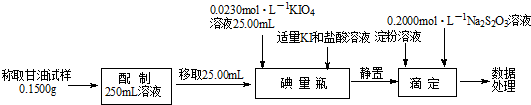
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
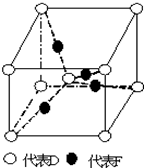 在周期表中1~36號之間的A、B、C、D、E、F六種元素,它們的原子序數依次增大,已知A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C元素原子的最外層有3個自旋方向相同的未成對電子,D原子核外電子有8種不同的運動狀態,E元素在第四周期,E的基態原子中未成對電子數是核外電子總數的$\frac{1}{4}$,F元素位于周期表的ds區,其基態原子最外能層只有一個電子.
在周期表中1~36號之間的A、B、C、D、E、F六種元素,它們的原子序數依次增大,已知A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C元素原子的最外層有3個自旋方向相同的未成對電子,D原子核外電子有8種不同的運動狀態,E元素在第四周期,E的基態原子中未成對電子數是核外電子總數的$\frac{1}{4}$,F元素位于周期表的ds區,其基態原子最外能層只有一個電子. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
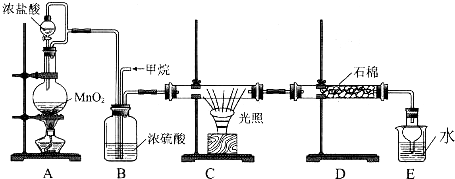
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com