
【題目】恒溫下,物質的量之比為2∶1的SO2和O2的混合氣體在容積為2 L的恒容密閉容器中發生反應:2SO2(g)+O2(g)![]() 2SO3(g)(正反應為放熱反應),n(SO2)隨時間變化關系如下表:
2SO3(g)(正反應為放熱反應),n(SO2)隨時間變化關系如下表:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列說法正確的是( )
A. 當容器中氣體的密度不變時,該反應達到平衡狀態
B. 該反應進行到第3分鐘時,逆反應速率小于正反應速率
C. 從反應開始到達到平衡,用SO3表示的平均反應速率為0.01 mol/(L·min)
D. 容器內達到平衡狀態時的壓強與起始時的壓強之比為5∶4
【答案】B
【解析】
A.未達到平衡狀態,氣體的密度也一直不變;
B.該反應進行到第3分鐘時向正反應方向進行;
C.根據v=△c/△t計算;
D.根據壓強之比等于物質的量之比計算。
A.容器內氣體密度不再發生變化,容器容積不變,氣體的總質量不變,所以氣體的密度始終不變,因此密度不能作為判斷平衡狀態的依據,故A錯誤;
B.根據表中數據可知反應進行到第3分鐘時沒有達到平衡狀態,反應向正反應方向進行,則逆反應速率小于正反應速率,故B正確;
C.由表格數據可知,4min時達到平衡,消耗二氧化硫為0.20mol-0.08mol=0.12mol,即生成SO3為0.12mol,濃度是0.06mol/L,則用SO3表示的平均反應速率為0.06mol/L÷4min=0.015 mol/(Lmin),故C錯誤;
D.開始SO2和O2的物質的量分別為0.2mol、0.1mol,由表格數據可知平衡時SO2、O2、SO3的物質的量分別為0.08mol、0.04mol、0.12mol,由壓強之比等于物質的量之比可知,達到平衡狀態時的壓強與起始時的壓強之比為(0.08+0.04+0.12)/(0.2+0.1)=4:5,故D錯誤;
答案選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.氯化鈉溶液在電流的作用下電離成鈉離子和氯離子
B.Cl2的水溶液能導電,但Cl2是非電解質
C.鹽酸能導電,故鹽酸是電解質
D.硫酸鋇難溶于水,但硫酸鋇是電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 在8NH3 + 3Cl2 = N2+ 6NH4Cl反應中,被氧化的原子與被還原的原子的物質的量之比為
A.8:3 B.1:3 C.3:8 D.3:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年是元素周期表發表150周年,期間科學家為完善周期表做出了不懈努力。中國科學院院士張青蓮教授曾主持測定了銦(49In)等9種元素相對原子質量的新值,被采用為國際新標準。銦與銣(37Rb)同周期。下列說法不正確的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子數與電子數的差值為17
C. 原子半徑:In>Al
D. 堿性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A(g)+3B(g)![]() 2C(g)+2D(g)在四種不同情況下的反應速率如下,其中表示反應速率最快的是( )
2C(g)+2D(g)在四種不同情況下的反應速率如下,其中表示反應速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】被稱為“國防金屬”的鎂 ,60%來自海洋,從海水中提取鎂的正確方法是( )

A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A~H的轉化關系如下圖所示。其中A是植物生長調節劑,它的產量可以用來衡量一個國家的石油化工發展水平;D是一種合成高分子材料,此類物質如果大量使用易造成“白色污染”;G能與NaHCO3溶液反應放出CO2氣體。
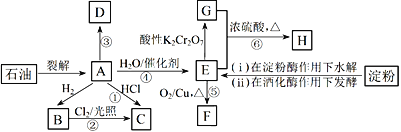
請回答下列問題:
(1)E的官能團名稱為____________。反應③的反應類型__________________________。
(2)關于有機物A、B、C、D的下列說法,正確的是___________________(選填序號)。
a.B不能使溴水或酸性高錳酸鉀溶液褪色,但A和D可以
b.B的同系物中,當碳原子數≥5時開始出現同分異構現象
c.等質量的A和D完全燃燒時消耗O2的量相等,生成CO2的量也相等
(3)寫出下列反應的化學方程式:
反應④:_________________________________。
反應⑤:_____________________________________。
(4)C是一種速效局部冷凍麻醉劑,可由反應①或②制備,請指出用哪一個反應制備較好:________,并說明理由:____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:將Cl2通入適量KOH溶液,產物中可能有KCl、KClO、KClO3,且![]() 的值與溫度高低有關。當n(KOH)=a mol,下列有關說法錯誤的是
的值與溫度高低有關。當n(KOH)=a mol,下列有關說法錯誤的是
A.若某溫度下,反應后![]() =11,則溶液中
=11,則溶液中![]() =
=![]()
B.參加反應的氯氣的物質的量等于![]() a mol
a mol
C.改變溫度,反應中轉移電子的物質的量ne的范圍:![]() a mol = ne =
a mol = ne = ![]() a mol
a mol
D.改變溫度,產物中KClO3的最大理論產量為![]() a mol
a mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌。以下是過氧化物法生產亞氯酸鈉的工藝流程圖:
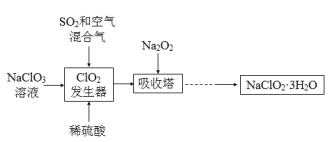
已知:
①NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO2·3H2O;
②純ClO2易分解爆炸,一般用稀有氣體或空氣稀釋至10%以下較安全;
(1)NaClO2中Cl的化合價為______。
(2)在發生器中鼓入SO2和空氣混合氣的原因是______ (填序號)。
A 空氣稀釋ClO2以防止爆炸
B SO2將NaClO3氧化成ClO2
C 稀硫酸可以增強NaClO3的氧化性
(3)Na2O2可改為H2O2和NaOH的混合溶液,吸收塔中發生的反應的化學方程式______;吸收塔的溫度不能超過20oC,主要原因是______。
(4)從濾液中得到NaClO2·3H2O粗晶體的實驗操作依次是______ (填序號)。
A 蒸餾 B 蒸發濃縮 C 灼燒 D 過濾 E 冷卻結晶
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com