
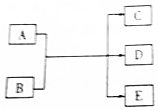
 一定條件下,物質A~E轉化關系如圖,其中A為單質,B為化合物,常溫下E為無色液體.
一定條件下,物質A~E轉化關系如圖,其中A為單質,B為化合物,常溫下E為無色液體. ,所含化學鍵類型為離子鍵、共價鍵,A與B反應的化學方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液顯藍色,則D與KI溶液反應的離子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化學鍵類型為離子鍵、共價鍵,A與B反應的化學方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液顯藍色,則D與KI溶液反應的離子方程式是2H++2I-+ClO-=Cl-+H2O+I2.分析 (1)x為第3周期原子半徑最小的元素,則x為Cl元素;y為第3周期原子半徑最大的元素,則y為Na元素;若A、C、D均含x(Cl)元素,A為單質,則A為氯氣;B、C、D均含y(Na)元素,D的溶液具有漂白性,則D為NaClO,再根據“B為化合物,常溫下E為無色液體”可知B為NaOH、E為水,據此進行解答;
(2)z、w為短周期相鄰元素,w原子的最外層電子數是內層電子數的兩倍,則w還有2個電子層,最外層含有4個電子,為C元素,x為B或N元素;若A為元素w的單質,則A為單質碳;B為z的最高價氧化物對應水化物,則B為強酸,x只能為N元素,故B為濃硝酸,據此進行解答.
解答 解:(1)x為第3周期原子半徑最小的元素,則x為Cl元素;y為第3周期原子半徑最大的元素,則y為Na元素;若A、C、D均含x(Cl)元素,A為單質,則A為氯氣;B、C、D均含y(Na)元素,D的溶液具有漂白性,則D為NaClO,再根據“B為化合物,常溫下E為無色液體”可知B為NaOH、E為H2O,
B為氫氧化鈉,屬于離子化合物,其電子式為 ,氫氧化鈉中含有離子鍵和共價鍵;
,氫氧化鈉中含有離子鍵和共價鍵;
氯氣和氫氧化鈉溶液反應生成氯化鈉、次氯酸鈉和水,反應為:Cl2+2NaOH=NaCl+NaClO+H2O;
D為次氯酸鈉,次氯酸鈉具有強氧化性,I-具有強還原性,二者發生氧化還原反應生成I2,反應的離子方程式為:2H++2I-+ClO-=Cl-+H2O+I2,
故答案為: ;離子鍵、共價鍵;Cl2+2NaOH=NaCl+NaClO+H2O;2H++2I-+ClO-=Cl-+H2O+I2;
;離子鍵、共價鍵;Cl2+2NaOH=NaCl+NaClO+H2O;2H++2I-+ClO-=Cl-+H2O+I2;
(2)z、w為短周期相鄰元素,w原子的最外層電子數是內層電子數的兩倍,則w還有2個電子層,最外層含有4個電子,為C元素,x為B或N元素;若A為元素w的單質,則A為單質碳;B為z的最高價氧化物對應水化物,則B為強酸,x只能為N元素,故B為濃硝酸,
w為C元素,原子序數為6,位于周期表中第二周期ⅣA族;
A為碳單質,B為濃硝酸,碳單質和濃硝酸加熱反應生成二氧化氮、二氧化碳和水,反應的化學方程式為:C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案為:第二周期ⅣA族;C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
點評 本題考查無機推斷,題目難度中等,明確常見元素及其化合物性質為解答關鍵,注意掌握原子結構與元素周期表、元素周期律的關系,試題側重考查學生的分析、理解能力及邏輯推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗 | 試劑及操作 | 現象 | |
| 試管 | 滴管 | ||
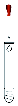 1.0mL | 飽和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol•L-1NaOH溶液:再滴加1.5mL1.0mol•L-1H2SO4溶液 | Ⅰ.紅色溶液中出現膠狀沉淀 |
| 0.1mol•L-1AlCl3溶液 | Ⅱ.加堿時出現白色沉淀,又逐漸溶解直至消失;加酸時產生白色沉淀,又逐漸溶解直至消失 | ||
| 0.1mol•L-1Fe(NO3)2溶液 | Ⅲ.加堿時生成白色沉淀迅速變成灰綠色,最后變成紅褐色;加酸后溶液變為黃色 | ||
| 新制飽和氯水 | Ⅳ.加堿時溶液變為無色;加酸后無色溶液變為淺黃綠色 | ||
| 實驗 | 試劑及操作 | 現象 | |
| 試管 | 滴管 | ||
 1.0 mL | 0.1 mol•L-1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol•L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol•L-1 NaOH溶液 | V.加酸時溶液無明顯現象;加堿后溶液依然沒有明顯變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燃料的脫硫脫氮、NO的催化轉化都是減少酸雨產生的措施 | |
| B. | 利用稀硝酸清除銅鏡表面的銅銹是因為稀硝酸具有強氧化性 | |
| C. | BaSO4難溶于水和強酸,在醫學上常用作鋇餐 | |
| D. | 食品包裝中常放入有硅膠和鐵粉的小袋,防止食物受潮和氧化變質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸酸與氫氧化鋇反應 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 過量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸銀溶液中加入銅粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 鋅與稀硝酸反應 Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO、H2S的轉化率之比為1:1 | |
| B. | 達平衡后H2S的體積分數為29.4% | |
| C. | 升高溫度,COS濃度減小,表明該反應是吸熱反應 | |
| D. | 恒溫下向平衡體系中再加入CO、H2S、COS、H2各1 mol,平衡不移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 開始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com