
丹參素能明顯抑制血小板的聚集.其結構如右下圖所示。下列有關說法正確的是
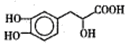
A. 丹參素在C原子上取代H的一氯代物有4種
B. 在Ni催化下lmol丹參素最多可與4molH2加成
C. 1mol丹參素在一定條件下與足量金屬鈉反應可生成4molH2
D. 丹參素能發生取代、消去、中和、氧化等反應
 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源:2017屆吉林省長春市高三下學期第二次質量監測理綜化學試卷(解析版) 題型:簡答題
2016年9月,“喬歌里1號”中國首臺靜默移動發電站MFC30正式問世,MFC30是基于甲醇重整制氫燃料電池發電技術。
(1)甲醇制氫方式主要有以下三種:反應Ⅰ甲醇水蒸氣重整制氫:CH3OH(g)+H2O(g)  CO2(g)+3H2(g) △H1=+49.4 kJ/mol反應Ⅱ甲醇分解制氫:CH3OH(g)
CO2(g)+3H2(g) △H1=+49.4 kJ/mol反應Ⅱ甲醇分解制氫:CH3OH(g) CO(g)+2H2(g) △H2=+90.6 kJ/mol反應Ⅲ氣態甲醇氧化重整制氫同時生成二氧化碳和氫氣:
CO(g)+2H2(g) △H2=+90.6 kJ/mol反應Ⅲ氣態甲醇氧化重整制氫同時生成二氧化碳和氫氣:
①已知CO的燃燒熱為283.0 kJ/mol,則反應Ⅲ的熱化學反應方程式為____________。
②該三種制氫方式中,等量的甲醇產生氫氣最多的是反應____________。(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
(2)實驗室模擬反應Ⅰ甲醇水蒸氣重整制制氫觀察,合成氣組成n(CH3OH): n(H2O)=1∶1時,體系中甲醇的平衡轉化率與溫度和壓強的關系如圖所示。

①該反應的平衡常數表達式為____________________。
②當溫度為250℃、壓強為P2時,反應達平衡時H2的體積分數為____________。
③圖中的壓強由小到大的順序是____________。
(3)MFC30燃料電池是以氫為燃料,Li2CO3與K2CO3混合的碳酸鹽為電解質的高溫型燃料電池,其負極的電極反應式為____________,正極上通入的氣體為____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二3月學業水平測試化學試卷(解析版) 題型:選擇題
下列有機化學方程式及反應類型均正確的是( )
A. CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 脂化反應
CH3COOCH2CH3+H2O 脂化反應
B. CH2=CH2+HOCl → HOCH2—CH2Cl 加聚反應
C. 2CH3CH2OH+O2 2CH3CHO+H2O 氧化反應
2CH3CHO+H2O 氧化反應
D. CH3Cl+Cl2 CH2Cl2+HCl 取代反應
CH2Cl2+HCl 取代反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二3月學業水平測試化學試卷(解析版) 題型:選擇題
科研人員發現放射性同位素鈥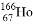 可有效地治療肝癌。該同位素原子核內中子數與電子數之差為( )
可有效地治療肝癌。該同位素原子核內中子數與電子數之差為( )
A. 32 B. 67 C. 99 D. 166
查看答案和解析>>
科目:高中化學 來源:2017屆四川省樂山市高三第二次調查研究考試理科綜合化學試卷(解析版) 題型:簡答題
碳酸亞鐵(FeCO3)是菱鎂礦的主要成分,將FeCO3加熱到200℃開始分解為FeO和CO2,若在空氣中高溫煅燒FeCO3生成Fe2O3。
I.已知25℃,101kPa時:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)請寫出FeCO3在空氣中煅燒生成Fe2O3的熱化學方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定條件下被還原為金屬鐵。
(2)據報道一定條件下Fe2O3可被甲烷還原為“納米級”的金屬鐵。其反應為:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序數為26的鐵元素位于元素周期表的第_______周期。
②反應在5L的密閉容器中進行,2min后達到平衡,測得Fe2O3在反應中質量消耗4.8g。則該段時間內用H2表達的平均反應速率為____________。
③將一定量的Fe2O3(s)和一定量的CH4(g)置于恒溫恒壓容器中,在一定條件下反應,能表明該反應達到平衡狀態的是___________。
a.CH4的轉化率等于CO的產率 b.混合氣體的平均相對分子質量不變
c.v正(CO):v逆(H2)=1:2 d.固體的總質量不變
(3)FeO可用CO進行還原,已知:t℃時,FeO(s)+CO(g) Fe(s)+CO2(g),K=0.5,若在1L密閉容器中加入0.04mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)的轉化率為50%,則x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密閉容器中加入0.04mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)的轉化率為50%,則x=_______。
Ⅲ. Fe2O3還可用來制備FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反應的平衡常效K1、K2、K3由大到小的順序是_______。通過控制條件,以上水解產物聚合生成聚合物的離子方程式為:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移動可采用的方法是__________(填字母)
a.加水稀釋 b.加入少量NaCl固體 c.升溫 d.加入少量Na2CO3固體
查看答案和解析>>
科目:高中化學 來源:2017屆河南省安陽市高三第二次模擬考試理綜化學試卷(解析版) 題型:填空題
黑火藥是我國古代的四大發明之一,距今已有1000多年的歷史,其成分是木炭(C)、硫粉(S)和硝酸鉀(KNO3)。回答下列有關問題:
(1)黑火藥爆炸生成無毒的氣體和K2S,該反應的化學方程式為________________。
(2)Se與S同主族,則Se原子的核外電子排布式為〔Ar〕________,有____對成對電子。
(3)C、N、O、K的電負性由大到小的順序是_________________。
(4) 黑火藥爆炸除生成K2S外,還生成少量K2S2,其結構類似于Na2O2。則K2S2中含有的化學鍵類型為_______________。
(5) K2S遇酸生成H2S,H2S分子中,S原子的雜化軌道類型是_________;KNO3可電離出NO3-,NO3-的空間構型是______________。
(6) K2S的晶胞結構如右圖所示。其中K+的配位數為_______,若K2S晶體的密度為ρg·cm-3,則晶胞中距離最近的兩個S2-核間距為_________cm(用NA表示阿伏伽德羅常數的值)
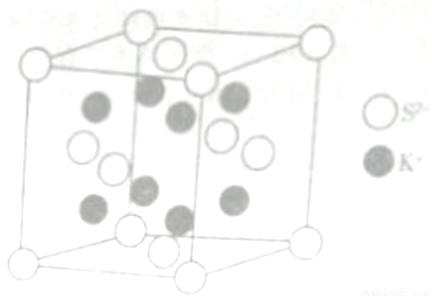
查看答案和解析>>
科目:高中化學 來源:2017屆河南省安陽市高三第二次模擬考試理綜化學試卷(解析版) 題型:選擇題
下列實驗對應的現象及結論均正確,且兩者具有因果關系的是
選項 | 實驗 | 現象 | 結論 |
A | 向稀硝酸與過量銅粉反應后的溶液中滴加稀硫酸 | 有氣泡生成 | 常溫下,銅與稀硫酸反應生成SO2 |
B | 在酒精燈上加熱鋁箔 | 鋁熔化,但熔化的鋁不滴落 | Al2O3的熔點比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有紅色變為紅褐色 | 減小反應物濃度、平衡向逆反應方向移動 |
D | 選用酚酞作試劑,用NaOH溶液滴定醋酸溶液 | 溶液變為粉紅色 | NaOH溶液過量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省黃岡市高三3月質量檢測理科綜合化學試卷(解析版) 題型:填空題
[化學-選修3:物質結構與性質]
鐵氧體是一種磁性材料,具有廣泛的應用。 -
(1)基態鐵原子的核外電子排布式為[Ar]_______。
(2)工業制備鐵氧體常使用水解法,制備時常加入尿素[CO(NH2)2 ]、醋酸鈉等堿性物質。尿素分子中四種不同元素的電負性由大至小的順序是____________;醋酸鈉中碳原子的雜化類型是_________。
(3)工業制備鐵氧體也可使用沉淀法,制備時常加入氨(NH3)、聯氨(N2H4)等弱堿。比較下表中氨(NH3)、聯氨(N2H4)的熔沸點,解釋其高低的主要原因________。
N2H4 | NH3 | |
熔點/℃ | 2 | -77.8 |
沸點/℃ | 113.5 | -33.5 |
(4)下圖是從鐵氧體離子晶體Fe3O4中,取出的能體現其晶體結構的一個立方體,則晶體中的氧離子是否構成了面心立方最密堆積______(填“是”或“否”),該立方體是不是Fe3O4的晶胞______(填“是”或“否”),立方體中三價鐵離子處于氧離子圍成的_____空隙(填空間結構)。

(5)解釋該Fe3O4晶體能導電的原因________,根據上圖計算Fe3O4晶體的密度_____g•cm-3。 (圖中a=0.42nm,計算結果保留兩位有效數字)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高一下學期第一次月考化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列說法正確的是( )
A. 含1molFeCl3的飽和溶液滴入沸水中得到膠體數目為NA
B. 在標準狀況下,22.4LCl2和HCl的混合氣體中含有的分子總數為2×6.02×1023
C. 常溫常壓下,7.8gNa2S固體和7.8gNa2O2固體中含有的陰離子數目均為0.1NA
D. 標準狀況下,Na2O2與足量的CO2反應生成2.24LO2,轉移電子數為0.4NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com