
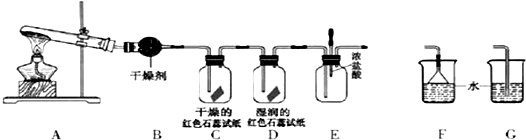
分析 (1)實驗室制備氨氣的原理是氯化銨和氫氧化鈣固體在加熱條件下反應,所以該裝置特點是加熱固體制備氣體的裝置;
(2)根據方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O結合n=$\frac{m}{M}$、v=nvm計算;
(3)氨氣易溶于水,密度比空氣小;
(4)氨氣與干燥的紅色石蕊試紙不變色,氨氣能使濕潤的紅色石蕊試紙變藍;
(5)氨氣與揮發的HCl會生成白煙氯化銨固體;
(6)因為氨氣極易溶于水,所以吸收氨氣時要用防倒吸裝置.
解答 解:(1)該裝置是加熱固體制備氣體的裝置,還可用于制取氧氣,如氯酸鉀在二氧化錳的催化作用下加熱生成氯化鉀和氧氣,反應的化學方程式為:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
故答案為:O2;
(2)n(NH4Cl)═$\frac{m}{M}$=$\frac{10.7g}{53.5g/mol}$=0.2mol,根據反應方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=n•Vm=0.2mol×22.4L/mol=4.48L,
故答案為:4.48;
(3)氨氣易溶于水,不能用排水法收集,氨氣密度比空氣小,所以用向下排空氣法收集,
故答案為:向下排空氣法;
(4)氨氣與干燥的紅色石蕊試紙不變色,氨氣遇水生成一水合氨,電離出的氫氧根離子能使紅色石蕊試紙變藍,所以氨氣能使濕潤的紅色石蕊試紙變藍,所以D中顏色發生變化,
故答案為:D;
(5)氨氣和氯化氫反應生成固體氯化銨,將兩支分別蘸取濃氨水和濃鹽酸的玻璃棒靠近,濃氨水揮發出的氨氣和濃鹽酸揮發出的氯化氫相遇反應,可以觀察到玻璃棒之間出現大量白煙;
故答案為:有白煙生成;
(6)因為氨氣極易溶于水,所以吸收氨氣時要用防倒吸裝置,F倒扣的漏斗具有球形部分起緩沖作用,能防止倒吸,
故答案為:F.
點評 本題考查了氨氣的性質分析應用.實驗室制備方法,注意實驗基本操作的理解應用和氨氣性質的熟練掌握是解題關鍵,題目難度不大.


 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案 學業測評一課一測系列答案
學業測評一課一測系列答案科目:高中化學 來源:2016-2017學年山西省高一上10月月考化學試卷(解析版) 題型:實驗題
粗食鹽常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等雜質離子,實驗室提純NaCl的流程如下:
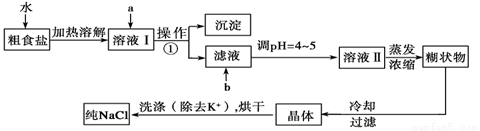
提供的試劑:飽和Na2CO3溶液、飽和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀鹽酸。
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,選出a所代表的試劑,按滴加順序依次為___________(只填化學式)。
(2)如何檢驗SO42-是否沉淀完全_____________。
(3)調節pH的目的是_____________,試劑b是________(填名稱)。
(4)洗滌除去NaCl晶體表面附帶的少量KCl,選用的試劑為______________,使用該試劑的目的是除去晶體表面的雜質,減少晶體的損耗。
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
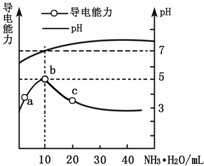 常溫下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及導電性變化如圖.下列分析不正確的是( )
常溫下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及導電性變化如圖.下列分析不正確的是( )| A. | b點溶液pH=5,此時酸堿恰好中和 | |
| B. | a~b點導電能力增強,說明HR為弱酸 | |
| C. | c點溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意點溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
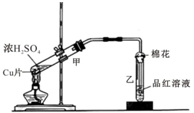 如圖為濃硫酸與銅片反應的裝置.請回答:
如圖為濃硫酸與銅片反應的裝置.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
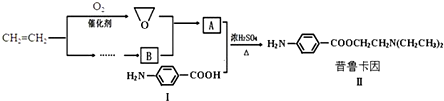

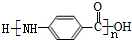 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ba2+、SO42-、Cl- | B. | Mg2+、K+、Cl-、NO3- | ||
| C. | H+、K+、CO32-、NO3- | D. | Ag+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

 .
. .F1和F2的關系為同分異構體.
.F1和F2的關系為同分異構體. ,二烯烴的通式是CnH2n-2.
,二烯烴的通式是CnH2n-2.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com