
反應條件是影響化學反應類型的重要因素。在光照下,1 mol苯和3 mol Cl2反應,生成“六六六”,化學方程式為
________________________________________________________________________,
反應類型為__________________。而在FeCl3的作用下,1 mol苯與1 mol Cl2反應,有氯化氫生成,化學方程式為________________________________,反應類型為_______________。
科目:高中化學 來源: 題型:閱讀理解
| 反應過程 | 化學方程式 | 焓變△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |

查看答案和解析>>
科目:高中化學 來源: 題型:






 和
和
 和
和




查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖北省武漢市高三二月調研測試理科綜合化學試卷(解析版) 題型:填空題
目前,消除氮氧化物污染有多種方法。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
寫出CH4 (g)與NO2 (g)反應生成N2 (g) ,CO2(g)和H2O(l)的熱化學方程 式_____________________
(2)用活性炭還原法處理氮氧化物。有關反應為:C(s)+2NO(g)  N2(g)+CO2(g)某研究小組向恒容密閉容器加入一定量的活性炭和NO,恒溫(T。C)條件下反應,反應進行到不同時間測得各物質的濃度如下
N2(g)+CO2(g)某研究小組向恒容密閉容器加入一定量的活性炭和NO,恒溫(T。C)條件下反應,反應進行到不同時間測得各物質的濃度如下
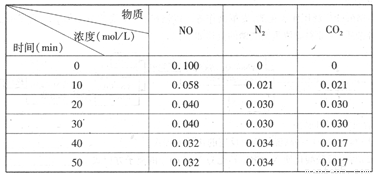
①不能作為判斷反應達到化學平衡狀態的依據 是_______
A.容器內CO2的濃度保持不變
B.v正(N2)=2 v正(NO)
C.容器內壓強保持不變
D.混合氣體的密度保持不變
E.混合氣體的平均相對分子質量保持不變
②在T。C時.該反應的平衡常數為_______(保留兩位小數);
③在30 min,改變某一條件,反應重新達到平衡,則改變的條件是_______
(3)科學家正在研究利用催化技術將超音速飛機尾氣中的NO和CO轉變成CO2和N2,其反應為:
2CO+2NO  N2+2CO2 ΔH<0 研究表明:在使用等質量催化劑時,增大催化劑的比表面積可提高化學反應速率.為了分別驗證溫度、催化劑的比表面積對化學反 應速率的影響規律、某同學設計了三組實驗,部分實驗條件已經填在下表中。
N2+2CO2 ΔH<0 研究表明:在使用等質量催化劑時,增大催化劑的比表面積可提高化學反應速率.為了分別驗證溫度、催化劑的比表面積對化學反 應速率的影響規律、某同學設計了三組實驗,部分實驗條件已經填在下表中。

①上表中:a=_______,b=________,e=________
②請在給出的坐標圖中,畫出上表中實驗II和實驗III條件下混合氣體中NO濃度隨時間變化的趨勢曲線圖,并標明相應的實驗編號

查看答案和解析>>
科目:高中化學 來源:2014屆甘肅省高二下學期期末考試化學試卷(解析版) 題型:推斷題
酒石酸是某種降壓藥物的載體,可用1,3-丁二烯為原料合成,其流程如下:

已知:① 
② D的分子組成是C4H8O2Cl2 ,核磁共振氫譜顯示其有三個峰。
(1)D中所含官能團的名稱是 。
(2)C轉化為D的反應類型是 。
(3)B存在順反異構,它的順式結構式是 。
(4)D轉化為E的化學反應方程式是 。
(5)與C組成相同、屬于酯類、能發生銀鏡反應的有機化合物的結構簡式 。
(6)F轉化為G的化學反應方程式是 。
(7)F與乙二醇在一定條件下可以發生縮聚反應,該反應的化學方程式是_______ 。
(8)欲得到較純凈的酒石酸,需將G從其溶液中分離提純,查閱相關資料得知G的溶解度受溫度影響較大,則分離提純G的方法是 。
查看答案和解析>>
科目:高中化學 來源:2012年蘇教高中化學選修6 4.1硫代硫酸鈉與酸反應速率的影響練習卷(解析版) 題型:實驗題
影響化學反應速率的因素很多,某校化學小組用實驗的方法進行探究。
實驗一:他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)設計實驗方案來研究影響反應速率的因素。
甲同學的實驗報告如下表:
|
實驗步驟 |
現象 |
結論 |
|
①分別取等體積的2 mol·L-1的硫酸于試管中 ②____________ |
反應速率Mg>Fe,Cu不反應 |
金屬的性質越活潑,反應速率越快 |
(1)甲同學表中實驗步驟②為____________________________。
(2)甲同學的實驗目的是____________________________________________________
________________________________________________________________________;
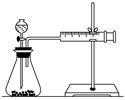
要得出正確的實驗結論,還需控制的實驗條件是____________。乙同學為了更精確地研究濃度對反應速率的影響,利用如圖所示裝置進行定量實驗。
(3)乙同學在實驗中應該測定的數據是
________________________________________________________________________
________________________________________________________________________。
(4)乙同學完成該實驗應選用的實驗藥品是____________
________________________________________________________________________,
該實驗中不選用某濃度的硫酸,理由是______________________________________
________________________________________________________________________。
實驗二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高錳酸鉀酸性溶液和草酸溶液反應時,發現開始一段時間,反應速率較慢,溶液褪色不明顯;但不久突然褪色,反應速率明顯加快。
(5)針對上述實驗現象,丙同學認為KMnO4與H2C2O4反應放熱,導致溶液溫度升高,反應速率加快。從影響化學反應速率的因素看,你猜想還可能是______________的影響。
(6)若用實驗證明你的猜想,除高錳酸鉀酸性溶液、草酸溶液外,還需要選擇的試劑最合理的是________(填字母)。
A.硫酸鉀 B.硫酸錳
C.二氯化錳 D.水
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com