
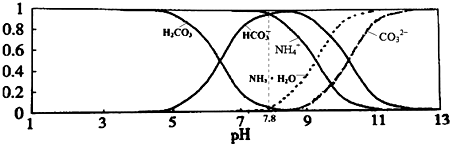
| A. | 當溶液的pH=9時,溶液中存在下列關系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒關系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由圖可知,往該溶液中逐滴滴加氫氧化鈉時NH4+濃度逐漸減小,HCO3-濃度先增大后減小 | |
| D. | 通過分析可知常溫下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
分析 A.當pH=9時,結合圖象判斷溶液中各離子濃度大小;
B.根據碳酸氫銨溶液中的物料守恒分析;
C.該碳酸氫銨溶液的pH=7.8,結合圖象判斷滴入氫氧化鈉溶液后NH4+和HCO3-濃度變化;
D.碳酸氫啊溶液顯示堿性,根據鹽的水解原理判斷二者的酸堿性強弱及電離平衡常數大小.
解答 解:A.結合圖象可知,溶液的pH=9時,溶液中離子濃度大小為:c(HCO3-)>c(NH4+)>c(NH3•H2O)>c(CO32-),故A錯誤;
B.NH4HCO3溶液中存在物料守恒:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),溶液顯堿性則c(H+)<c(OH-),所以c(NH4+)+c(NH3•H2O)+c(H+)<c(OH-)+2c(CO32-)+c(H2CO3),故B錯誤;
C.0.1mol/L的NH4HCO3溶液的pH=7.8,根據圖象可知,當溶液pH增大時,銨根離子濃度逐漸減小,而碳酸氫根離子能夠先增大后減小,故C正確;
D.由于0.1mol/L的NH4HCO3溶液的pH=7.8,說明碳酸氫根離子的水解程度大于銨根離子的水解程度,則一水合氨的電離平衡常數大于Ka1(H2CO3),Ka1(H2CO3)<Kb(NH3•H2O),故D錯誤;
故選C.
點評 本題結合圖象考查了離子濃度大小比較、鹽的水解原理等知識,題目難度中等,明確圖象曲線變化的含義為解答關鍵,注意掌握電荷守恒、物料守恒、鹽的水解原理在判斷離子濃度大小中的應用方法.


 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
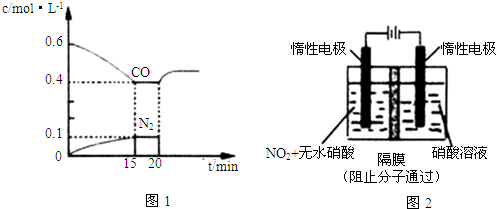
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
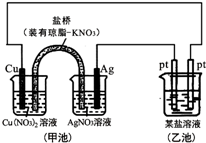
| A. | 圖中甲池為原電池裝置,電子從銅電極通過溶液和鹽橋流向Ag電極 | |
| B. | 實驗過程中,甲池左側燒杯中NO3-的濃度不變 | |
| C. | 若用銅制U形物代替“鹽橋”,工作一段時間后取出U形物稱量,質量不變 | |
| D. | 若甲池中Ag電極質量增加5.4g時,乙池某電極析出1.6g金屬,則乙中的某鹽溶液不可能是AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K2CO3 | B. | Na2SO4 | C. | Ca(OH)2 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通過紅外光譜分析可以區分乙醇和乙酸 | |
| B. | 可用蘸濃鹽酸的棉棒檢驗輸送氨氣的管道是否漏氣 | |
| C. | 光催化還原水制氫比電解水制氫更節能環保、更經濟 | |
| D. | 石油的裂解、煤的干餾、蛋白質的鹽析和淀粉的水解都是化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | T℃時,測得某NaNO2溶液的pH=8,則溶液中c(Na+)_c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | 已知H3PO2(次磷酸)是一種一元中強酸,則其與NaOH所形成的酸式鹽NaH2PO2溶液中存在下列離子濃度大小關系c(Na+)>c(H2PO2-)c(OH-)>c(H+) | |||||||||
| C. | 一定溫度下,利用pH計測定不同濃度醋酸溶液的pH值,得到如表數據:
| |||||||||
| D. |  已知,某溫度時Ag2SO4在水中的沉淀溶解平衡曲線如圖,可知Ag2SO4在此溫度下的溶度積常數(Ksp)為8×10-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時:當外電路通過1mol的電子時,理論上負極板的質量增加了151.5g | |
| B. | 充電時:陽極反應是PbSO4-2e-+2H2O=PbO2+SO42-+4H+ | |
| C. | 放電時:正極反應是Pb-2e-+SO42-=PbSO4 | |
| D. | 充電時:鉛蓄電池的陰極應與電源的正極相連 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com