
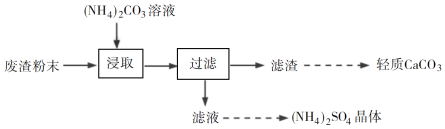
【題目】實驗室以工業廢渣(主要含CaSO4·2H2O,還含少量SiO2、Al2O3、Fe2O3)為原料制取輕質CaCO3和(NH4)2SO4晶體,其實驗流程如下:
(1)室溫下,反應CaSO4(s)+![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)達到平衡,則溶液中
(aq)達到平衡,則溶液中 =________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
=________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
(2)將氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其離子方程式為________;浸取廢渣時,向(NH4)2CO3溶液中加入適量濃氨水的目的是________。
(3)廢渣浸取在如圖所示的裝置中進行。控制反應溫度在60~70 ℃,攪拌,反應3小時。溫度過高將會導致CaSO4的轉化率下降,其原因是________;保持溫度、反應時間、反應物和溶劑的量不變,實驗中提高CaSO4轉化率的操作有________。

(4)濾渣水洗后,經多步處理得到制備輕質CaCO3所需的CaCl2溶液。設計以水洗后的濾渣為原料,制取CaCl2溶液的實驗方案:______[已知pH=5時Fe(OH)3和Al(OH)3沉淀完全;pH=8.5時Al(OH)3開始溶解。實驗中必須使用的試劑:鹽酸和Ca(OH)2]。
【答案】1.6×104 ![]() +NH3·H2O
+NH3·H2O![]()
![]() +
+![]() +H2O(或
+H2O(或![]() +NH3·H2O
+NH3·H2O![]()
![]() +
+![]() +H2O) 增加溶液中
+H2O) 增加溶液中![]() 的濃度,促進CaSO4的轉化 溫度過高,(NH4)2CO3分解 加快攪拌速率 在攪拌下向足量稀鹽酸中分批加入濾渣,待觀察不到氣泡產生后,過濾,向濾液中分批加入少量Ca(OH)2,用pH試紙測量溶液pH,當pH介于5~8.5時,過濾
的濃度,促進CaSO4的轉化 溫度過高,(NH4)2CO3分解 加快攪拌速率 在攪拌下向足量稀鹽酸中分批加入濾渣,待觀察不到氣泡產生后,過濾,向濾液中分批加入少量Ca(OH)2,用pH試紙測量溶液pH,當pH介于5~8.5時,過濾
【解析】
(1)反應CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)的平衡常數表達式為
CaCO3(s)+SO42-(aq)的平衡常數表達式為![]() ,結合CaSO4和CaCO3的Ksp計算;
,結合CaSO4和CaCO3的Ksp計算;
(2)氨水與NH4HCO3反應生成(NH4)2CO3;加入氨水抑制(NH4)2CO3的水解;
(3)溫度過高,(NH4)2CO3分解,使CaSO4轉化率下降;保持溫度、反應時間、反應物和溶劑的量不變,提高CaSO4轉化率即提高反應速率,結合反應的特點從影響反應速率的因素分析;
(4)根據工業廢渣中的成分知,浸取、過濾后所得濾渣中含CaCO3、SiO2、Al2O3和Fe2O3;若以水洗后的濾渣為原料制取CaCl2溶液,根據題給試劑,首先要加入足量鹽酸將CaCO3完全轉化為CaCl2,同時Al2O3、Fe2O3轉化成AlCl3、FeCl3,過濾除去SiO2,結合題給已知,再利用Ca(OH)2調節pH除去Al3+和Fe3+。
(1)反應CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)達到平衡時,溶液中
CaCO3(s)+SO42-(aq)達到平衡時,溶液中![]() =
=![]() =
=![]() =
=![]() =1.6×104。答案:1.6×104
=1.6×104。答案:1.6×104
(2)NH4HCO3屬于酸式鹽,與氨水反應生成(NH4)2CO3,反應的化學方程式為NH4HCO3+NH3·H2O=(NH4)2CO3+H2O[或NH4HCO3+NH3·H2O![]() (NH4)2CO3+H2O],離子方程式為HCO3-+NH3·H2O=NH4++CO32-+H2O(或HCO3-+NH3·H2O
(NH4)2CO3+H2O],離子方程式為HCO3-+NH3·H2O=NH4++CO32-+H2O(或HCO3-+NH3·H2O![]() NH4++CO32-+H2O);浸取廢渣時,加入的(NH4)2CO3屬于弱酸弱堿鹽,溶液中存在水解平衡:CO32-+NH4++H2O
NH4++CO32-+H2O);浸取廢渣時,加入的(NH4)2CO3屬于弱酸弱堿鹽,溶液中存在水解平衡:CO32-+NH4++H2O![]() HCO3-+NH3·H2O,加入適量濃氨水,水解平衡逆向移動,溶液中CO32-的濃度增大,反應CaSO4(s)+CO32-(aq)
HCO3-+NH3·H2O,加入適量濃氨水,水解平衡逆向移動,溶液中CO32-的濃度增大,反應CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)正向移動,促進CaSO4的轉化。答案:HCO3-+NH3·H2O=NH4++CO32-+H2O(或HCO3-+NH3·H2O
CaCO3(s)+SO42-(aq)正向移動,促進CaSO4的轉化。答案:HCO3-+NH3·H2O=NH4++CO32-+H2O(或HCO3-+NH3·H2O![]() NH4++CO32-+H2O) 增加溶液中CO32-的濃度,促進CaSO4的轉化
NH4++CO32-+H2O) 增加溶液中CO32-的濃度,促進CaSO4的轉化
(3)由于銨鹽具有不穩定性,受熱易分解,所以溫度過高,(NH4)2CO3分解,從而使CaSO4轉化率下降;由于浸取過程中的反應屬于固體與溶液的反應(或發生沉淀的轉化),保持溫度、反應時間、反應物和溶劑的量不變,提高CaSO4轉化率即提高反應速率,結合外界條件對化學反應速率的影響,實驗過程中提高CaSO4轉化率的操作為加快攪拌速率(即增大接觸面積,加快反應速率,提高浸取率)。答案:溫度過高,(NH4)2CO3分解 加快攪拌速率
(4)工業廢渣主要含CaSO4·2H2O,還含有少量SiO2、Al2O3和Fe2O3,加入(NH4)2CO3溶液浸取,其中CaSO4與(NH4)2CO3反應生成CaCO3和(NH4)2SO4,SiO2、Al2O3和Fe2O3都不反應,過濾后所得濾渣中含CaCO3、SiO2、Al2O3和Fe2O3;若以水洗后的濾渣為原料制取CaCl2溶液,根據題給試劑,首先要加入足量鹽酸將CaCO3完全轉化為CaCl2,發生的反應為CaCO3+2HCl=CaCl2+H2O+CO2↑,與此同時發生反應Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2不反應,經過濾除去SiO2;得到的濾液中含CaCl2、AlCl3、FeCl3,根據“pH=5時Fe(OH)3和Al(OH)3沉淀完全,pH=8.5時Al(OH)3開始溶解”,為了將濾液中Al3+、Fe3+完全除去,應加入Ca(OH)2調節溶液的pH介于5~8.5[加入Ca(OH)2的過程中要邊加邊測定溶液的pH],然后過濾即可制得CaCl2溶液。答案:在攪拌下向足量稀鹽酸中分批加入濾渣,待觀察不到氣泡產生后,過濾,向濾液中分批加入少量Ca(OH)2,用pH試紙測得溶液pH,當pH介于5~8.5時,過濾


 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:
【題目】環戊二烯( )是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
)是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
對于反應:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某溫度下,等物質的量的碘和環戊烯(![]() )在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
)在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
A.通入惰性氣體 B.提高溫度
C.增加環戊烯濃度 D.增加碘濃度
(3)環戊二烯容易發生聚合生成二聚體,該反應為可逆反應。不同溫度下,溶液中環戊二烯濃度與反應時間的關系如圖所示,下列說法正確的是__________(填標號)。

A.T1>T2
B.a點的反應速率小于c點的反應速率
C.a點的正反應速率大于b點的逆反應速率
D.b點時二聚體的濃度為0.45 mol·L1
(4)環戊二烯可用于制備二茂鐵(Fe(C5H5)2結構簡式為 ),后者廣泛應用于航天、化工等領域中。二茂鐵的電化學制備原理如下圖所示,其中電解液為溶解有溴化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑)。
),后者廣泛應用于航天、化工等領域中。二茂鐵的電化學制備原理如下圖所示,其中電解液為溶解有溴化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑)。

該電解池的陽極為____________,總反應為__________________。電解制備需要在無水條件下進行,原因為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物含有C、H、O三種元素,其質譜如圖所示。將4.3 g該有機物在O2中充分燃燒,使生成物依次通過足量濃硫酸和堿石灰,濃硫酸增重2.7 g,堿石灰增重8.8 g,則:

(1)該有機物的摩爾質量為____________g/mol。
(2)該有機物的分子式為 。
(3)1mol該有機物與足量的金屬鈉反應產生1mol氫氣,核磁共振氫譜有兩個峰,且面積比為2∶1,請寫出其結構簡式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物Y具有抗菌、消炎作用,可由X制得。

下列有關化合物X、Y的說法正確的是
A. 1 mol X最多能與2 mol NaOH反應
B. Y與乙醇發生酯化反應可得到X
C. X、Y均能與酸性KMnO4溶液反應
D. 室溫下X、Y分別與足量Br2加成的產物分子中手性碳原子數目相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分離和提純的實驗中,所選用的方法或儀器不正確的是( )
序號 | A | B | C | D |
實驗目的 | 分離食鹽水與泥沙 | 分離水和CCl4 | 制取蒸餾水 | 從濃食鹽水中得到氯化鈉晶體 |
分離方法 | 過濾 | 萃取 | 蒸餾 | 蒸發 |
選用儀器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國古代勞動人民在生產生活中積累了豐富的經驗,很多生產過程的操作方法與化學實驗中的物質分離除雜方法相似。下列加有著重號的文字與對應分離方法正確的是( )
《本草集經注》 | 《通州煮海錄》 | 《名醫別錄》 | 《續遵義府志》 |
凡漬藥酒,皆須細切……便可漉出 | 海陸取鹵,日曬火煎,煮海熬波,鹵水成鹽 | 凡煮湯,欲微火,令小沸……箅渣取液 | 經月畫出蒸之……終乃得酒可飲 |
|
|
|
|
A.過濾、蒸餾、萃取、蒸發B.過濾、蒸發、萃取、蒸餾
C.蒸發、萃取、蒸餾、過濾D.萃取、蒸發、過濾、蒸餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】觀察下列實驗裝置圖,按要求作答:

(1)寫出圖中實驗操作的名稱:①_____ ③_____
(2)裝置④中所有玻璃儀器的名稱:_____,_____
(3)下列實驗需要在哪套裝置中進行:(填序號,每套裝置僅使用一次)
從 KCl溶液中獲取KCl晶體_____;從海水中提取水_____;分離CaCO3和水_____;分離植物油和水_____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨催化氧化是硝酸工業的基礎,氦氣在Pt催化劑作用下發生主反應Ⅰ和副反應Ⅱ:
Ⅰ.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-905 kJ/mol
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
物質中斷裂1mol化學鍵需要的能量/kJ | NO | O2 | N2 |
629 | 496 | 942 |
則△H2=___________。
(2)以Pt為催化劑,在1L密閉容器中充入1mol NH3和2mol O2,測得有關物質的量與溫度的關系如下圖:

①該催化劑在高溫時對反應__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃時,NH3的轉化率為____________。
③520℃時,反應Ⅱ的平衡常數K=________(數字計算式)。
④下列說法正確的是____________(填標號)。
A 工業上氨催化氧化生成NO時,最佳溫度應控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡轉化率
C 投料比不變,增加反應物的濃度可以提高NH3生成NO的平衡轉化率
D 使用催化劑時,可降低反應的活化能,加快其反應速率
⑤溫度高于840℃時,NO的物質的量減少的原因可能是____________。
(3)在有氧條件下,新型催化劑M能催化NH3與NOx反應生成N2。
①NH3與NO2生成N2的反應中,當生成1mol N2時,轉移的電子數為___________mol。
②將一定比例的O2、NH3和NOx的混合氣體,勻速通入裝有催化劑的反應器中反應。
反應相同時間NOx的去除率隨反應溫度的變化曲線如下圖所示,在50-250℃范圍內隨著溫度的升高,NOx的去除率先迅速上升后上升緩慢的主要原因是_______________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗腫瘤作用,可由化合物X在一定條件下合成:

下列說法正確的是( )
A. X分子中所有原子一定在同一平面上
B. X、Y分子中均含有1個手性碳原子
C. 1molX與溴水充分反應,最多消耗Br2的物質的量為2mol
D. 1molY與NaOH溶液充分反應,最多消耗NaOH的物質的量為4mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com