
下列有關物質的性質與應用不相對應的是
A. 氨氣能與氯氣生成氯化銨,可用濃氨水檢驗輸送氯氣的管道是否泄漏
B.SO2有強還原性,用 SO2漂白紙漿
C.熟石膏與水的糊狀混合物會很快凝固,可用它制作模型和石膏繃帶
D.鋁有強還原性且轉化為氧化鋁時放出大量的熱,可用鋁粉來還原某些金屬氧化物
 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案科目:高中化學 來源:2015-2016學年河北省高二下期中化學試卷(解析版) 題型:選擇題
原子軌道的雜化不但出現在分子中,原子團中同樣存在雜化軌道的。在 SO42-中S原子的雜化方式為( )
A.sp B.sp2 C.s p3 D.無判法斷
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三高考模擬九化學試卷(解析版) 題型:選擇題
設NA為阿伏加羅常數的值,下列敘述正確的是
A.在標況下,11.2 L NO與11.2 L O2混合后所含分子數為0.75NA
B.常溫常壓下,16gO3所含的電子數為8NA
C.5NH4NO3  2HNO3+4N2↑+9H2O反應中,生成28gN2時,轉移的電子數目為3.75NA
2HNO3+4N2↑+9H2O反應中,生成28gN2時,轉移的電子數目為3.75NA
D.鋁跟氫氧化鈉溶液反應生成1mol氫氣時,轉移的電子數為NA
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三高考模擬八化學試卷(解析版) 題型:簡答題
某礦石含碳酸鎂和石英,制備高純硅和硅膠的工藝流程如下:
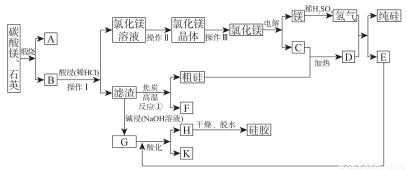
(1)“硅膠”冶常用作_______________ ,也可以用作__________的載體。 A 的結構式為________。
(2)制備粗硅的方程式為_______。
(3)操作I為_____________,操作Ⅱ為_______________,操作Ⅲ所用儀器有鐵架臺(帶鐵圈)、酒精燈、_______________等。
(4)操作Ⅲ,需要在氯化氫氣流中加熱脫水的原因是_______________。
(5)溶液G用E酸化的方程式為_______________。
(6)電解飽和的K溶液的離子方程式為____________,陽極電極方程式為_______________。
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三高考模擬八化學試卷(解析版) 題型:選擇題
下表各組物質中,物質之間不可能實現如圖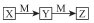 所示轉化
所示轉化
選項 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
查看答案和解析>>
科目:高中化學 來源:2016屆青海省西寧市等校高三下聯考理綜化學試卷(解析版) 題型:簡答題
【化學——選修2:化學與技術】聯合生產是實現節能減排的重要措施,工業上合成氨和硝酸的聯合生產具有重要意義。下面是工業上合成氨的簡易流程:
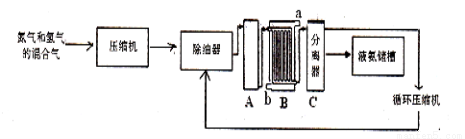
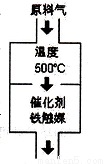
(1)設備A內部結構如右下圖所示,其名稱是________ ,其中發生的化學反應方程式為_________;生產中原料氣必須進行脫硫,目的是____________。選擇500℃進行反應的主要原因是___________;
(2)設備B的名稱是冷凝塔,圖中a和b是兩個通水口,其中入水口是 (填“a”或“b”)。
(3)氮氣和氫氣的混合氣體通過壓縮機壓縮的原因是________________________________。
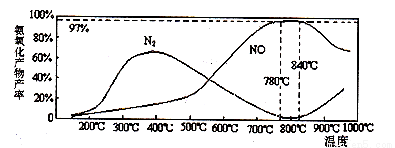
(4)生產出來的NH3可以用來生產硝酸。其中在氨氣催化氧化過程中,不同溫度下生成產物可能有所不同,溫度對氨氧化產物產率的影響如下圖所示;當溫度大于900℃時,NO的產率下降的主要原因是__________________。
(5)某化肥廠用NH3制備NH4NO3。已知:由NH3制NO的產率是94%,NO制HNO3的產率是89%,則制HNO3所用NH3的質量占總耗NH3質量(不考慮其它損耗)的 %(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源:2016屆青海省西寧市等校高三下聯考理綜化學試卷(解析版) 題型:選擇題
用下列實驗裝置進行相應實驗,能達到實驗目的的是( )
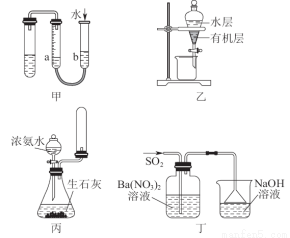
A.用圖甲的方法不能檢查此裝置的氣密性
B.圖乙可以作為CCl4萃取溴水后的分液裝置
C.實驗室用圖丙所示裝置制取少量氨氣
D.圖丁洗氣瓶中的白色沉淀為BaSO3
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省沙市高三下高考第一次模擬理綜化學試卷(解析版) 題型:填空題
【化學——選修3:物質結構與性質】
物質的結構決定物質的性質。請回答下列涉及物質結構和性質的問題:
(1)第二周期中,元素的第一電離能處于B與N之間的元素有_________種。
(2)某元素位于第四周期Ⅷ族,其基態原子的未成對電子數與基態碳原子的未成對電子數相同,則其基態原子的價層電子排布式為_________________。
(3)乙烯酮(CH2=C=O)是一種重要的有機中間體,可用CH3COOH在(C2H5O)3P=O存在下加熱脫H2O得到。乙烯酮分子中碳原子雜化軌道類型是_____________,1mol(C2H5O)3P=O分子中含有的σ鍵的數目為__________________。
(4)已知固態NH3、H2O、HF的氫鍵鍵能和結構如下:
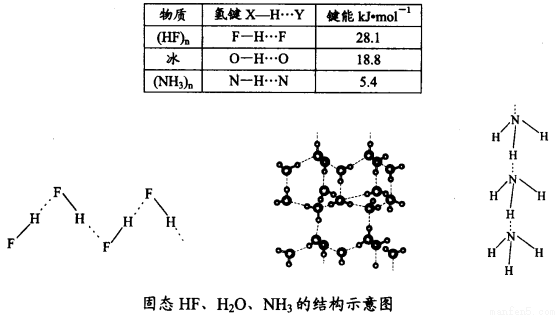
解釋H2O、HF、NH3沸點依次降低的原因___________________。
(5)碳化硅的結構與金剛石類似,其硬度僅次于金剛石,具有較強的耐磨性能。碳化硅晶胞結構中每個碳原子周圍與其距離最近的硅原子有________個,與碳原子等距離最近的碳原子有__________個。已知碳化硅晶胞邊長為apm,則晶胞圖中1號硅原子和2號碳原子之間的距離為________pm,碳化硅的密度為__________g/cm3。
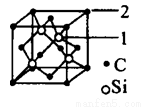
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江牡丹江一中高一下期中化學試卷(解析版) 題型:填空題
50 mL 0.50 mol·L-1的鹽酸與50 mL 0.55 mol·L-1NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱,完成下列問題:

(1)從實驗裝置上看,圖中尚缺少的一種玻璃用品是_____________。請指出裝置中的另外錯誤是 。
(2)燒杯間填滿碎紙條的作用是___________。
(3)大燒杯上如不蓋硬紙板,求得的中和熱數值___________(填“偏大”“偏小”“無影響”)。
(4)實驗中改用60mL0.50mol·L-1的鹽酸跟60mL0.55mol·L-1NaOH溶液進行上述實驗相比,所放出的熱量___________(填“相等”“不相等”),所求中和熱___________(填“相等”“不相等”)。
(5)用相同濃度體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會_____;用50 mL 0.50 mol·L-1NaOH溶液進行上述實驗,測得的中和熱的數值會_____(均填“偏大”“偏小”“無影響”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com