
【題目】四氯化錫可用作媒染劑。利用如圖所示裝置可以制備四氯化錫(部分夾持裝置已略去)
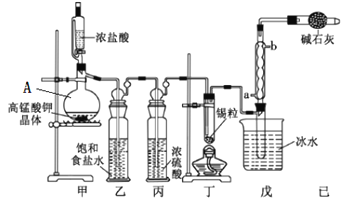
有關信息如下表:
化學式 | SnCl2 | SnCl4 |
熔點/℃ | 246 | 33 |
沸點/℃ | 652 | 144 |
其他性質 | 無色晶體,易氧化 | 無色液體,易水解 |
回答下列問題:
(1)甲裝置中儀器A的名稱為___________。
(2)用甲裝置制氯氣,MnO4被還原為Mn2+,該反應的離子方程式為________________。
(3)將裝置如圖連接好,檢查氣密性,慢慢滴入濃鹽酸,待觀察到__________(填現象)后,開始加熱丁裝置,錫熔化后適當增大氯氣流量,繼續加熱丁裝置,此時繼續加熱丁裝置的目的是:①促進氯氣與錫反應;②_______________________。
(4)乙裝置的作用____________,如果缺少乙裝置,可能發生的副反應的化學方程式為_________;己裝置的作用是_____(填序號)。
A.防止空氣中CO2氣體進入戊裝置
B.除去未反應的氯氣,防止污染空氣
C.防止水蒸氣進入戊裝置的試管中使產物水解
D.防止空氣中O2進入戊裝置的試管中使產物氧化
(5)某同學認為丁裝置中的反應可能產生SnCl2雜質,以下試劑中不可用于檢測是否產生SnCl2 的有_______(填序號)。
A.H2O2溶液 B.酸性高錳酸鉀溶液 C.AgNO3溶液 D.溴水
(6)反應中用去錫粒1.19 g,反應后在戊裝置的試管中收集到2.04 g SnCl4,則SnCl4的產率為_______(保留2位有效數字)。
【答案】蒸餾燒瓶 10Cl-+16H++2MnO4-=5Cl2↑+8H2O+2Mn2+ 丁中充滿黃綠色氣體 促進四氯化錫揮發 除去氯氣中混有的氯化氫氣體 Sn+2HCl=SnCl2+H2 BC AC 78%
【解析】
SnCl4極易水解,應在無水環境下制備和保存。A裝置制備氯氣,由于濃鹽酸易揮發,制備的Cl2中含有HCl及水蒸氣,乙中盛放飽和食鹽水除去HCl,丙中濃硫酸吸收水蒸氣,干燥氯氣,并用氯氣排盡裝置中空氣,防止影響實驗。氯氣與Sn在丁處試管中反應生成SnCl4,反應生成SnCl4的為氣態,在戊處冷卻收集得到液態SnCl4,干燥管中堿石灰吸收未反應的氯氣,防止污染環境,同時吸收空氣中的水蒸氣,防止進入收集SnCl4的試管使其水解。
(1)根據裝置圖可知:甲裝置中儀器A的名稱為蒸餾燒瓶,故答案為:蒸餾燒瓶;
(2)在A中KMnO4與濃鹽酸發生氧化還原反應產生氯氣,發生反應的離子方程式為:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,故答案為:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)若整個裝置中充分氯氣時,即丁裝置充滿黃綠色氣體,再加熱熔化錫粒合成SnCl4,加熱丁裝置,促進氯氣與錫反應,同時使生成的SnCl4氣化,有利于從混合物中分離出來,便于在戊處冷卻收集,故答案為:丁中充滿黃綠色氣體;促進四氯化錫揮發;
(4) 乙裝置的作用是除去氯氣中混有的HCl雜質;
如果缺少乙裝置,氯氣中混有的HCl氣體與Sn反應產生SnCl2與氫氣,其方程式為Sn+2HCl=SnCl2+H2↑,使SnCl4產率降低,且氯氣與氫氣反應可能發生爆炸;
己裝置是干燥管,干燥管中堿石灰吸收未反應的氯氣,防止污染環境,同時吸收空氣中的水蒸氣,防止進入收集SnCl4的試管使其水解,故合理選項是BC;
(5)A. SnCl2易被氧化,H2O2溶液可以將Sn2+氧化,但沒有明顯現象,A項錯誤;
B. SnCl2易被氧化,與酸性高錳酸鉀溶液混合,若褪色,則含有SnCl2,否則無SnCl2,B項正確;
C.使用AgNO3溶液可以檢驗氯離子,不能檢驗二價錫元素,C項錯誤;
D.與溴水混合,若橙色褪去,則說明含有SnCl2,SnCl2與溴水發生了氧化還原反應,否則無SnCl2,D項正確;故答案為:AC;
(5) 用去錫粒1.19g,其物質的量為n(Sn)=1.19g÷119g/mol=0.01mol,根據Sn原子守恒可知在理論生成SnCl4為0.01mol,則SnCl4的產率為![]() ×100%
×100%![]() 78%,故答案為:78%。
78%,故答案為:78%。


 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是(NA表示阿伏加德羅常數的值)( )
A.常溫常壓下,18 g ![]() 所含的電子數為10NA
所含的電子數為10NA
B.56 g金屬鐵與氯氣反應時得到的電子數為3NA
C.標準狀況下,22.4 L氧氣所含的氧原子數為2NA
D.常溫常壓下,22.4 L CO2與足量Na2O2反應轉移電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的Mg、Zn、Al混合物與足量稀H2SO4反應,生成H22.8L(標準狀況),原混合物質量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置圖所示的實驗操作,正確的是( )
A. 干燥Cl2 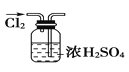
B. 配制100 mL 0.1 mol·L-1 硫酸溶液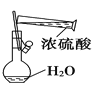
C. 分離沸點相差較大的互溶液體混合物 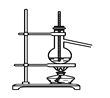
D. 分離互不相溶的兩種液體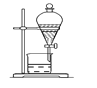
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請仔細觀察以下2個裝置,下列說法正確的是
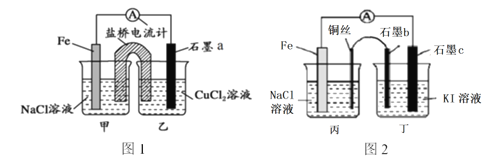
A. 圖1石墨a為正極,圖2石墨c也為正極
B. 圖1是原電池裝置,鹽橋的作用是使電解質溶液始終保持電中性,以提供持續穩定的電流,圖2裝置不會產生電流
C. 圖1石墨a電極上發生的反應為:O2+2H2O+4e-=4OH-
D. 圖2石墨b上的產物能使淀粉溶液變藍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是自然界碳循環中的重要物質。下列過程會引起大氣中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃燒 D. 碳酸鹽的沉積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為原子序數遞增的4種短周期元素,其中Y、Z為金屬元素。X、Y、Z、W的最高價氧化物對應的水化物甲、乙、丙、丁之間存在如圖所示反應關系(圖中“一”相連的兩種物質能發生反應)。下列判斷正確的是
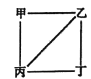
A. X是元素周期表中非金屬性最強的元素
B. Z冶煉可通過電解其氯化物的方式獲得
C. 4種原子中,Y離子半徑最小
D. W的陰離子可能促進水的電離
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】膽礬(CuSO4·5H2O)有廣泛的用途。某研究性學習小組利用某次實驗后的稀硫酸、稀硝酸混合液制備膽礬。實驗流程如下:
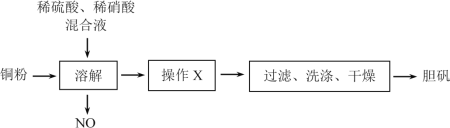
請回答下列問題:
(1)操作X為___,___。
(2)NO需要回收利用,寫出NO與空氣、H2O反應生成硝酸的化學方程式___。
(3)現有48g含CuO質量分數為20%的銅粉,與一定量的稀硫酸、稀硝酸混合液恰好完全反應生成CuSO4。試求:
①理論上生成膽礬的質量為___g。
②原混合液中硫酸和硝酸的物質的量之比。___(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,金屬鈉和CO2可制得金剛石:4Na+3CO2![]() 2Na2CO3+C(s,金剛石)
2Na2CO3+C(s,金剛石)
完成下列填空:
(1)上述反應中涉及的元素的原子半徑從大到小的順序為____。
(2)能證明碳元素與氧元素非金屬強弱的事實是___(選填編號)。
a.最高價氧化物水化物的酸性 b.兩種元素的氣態氫化物的沸點
c.CO2中元素的化合價 d.氣體氫化物受熱分解的溫度
(3)高壓下,科學家成功地將CO2轉化為具有類似SiO2結構的原子晶體,比較SiO2與CO2這兩種原子晶體的熔沸點高低,并說明理由:___。
常壓 | 熔點(℃) | 沸點(℃) |
鈉 | 97.8 | 882.9 |
Na2CO3 | 851 | 1850分解 |
金剛石 | 3550 | … |
石墨 | 3850 | 4250 |
(4)若在2L密閉容器中,10min內金屬鈉減少了0.2mol,則CO2的平均反應速率為___。該反應在常壓1000℃下進行,根據右表數據,該反應的平衡常數表達式K=___。
(5)若在2L密閉容器中,常壓、1000℃下,起始時,下列物理量能說明該反應已達到平衡狀態的是____。
a.氣體的平均摩爾質量不變 b.3v消耗(Na)=4v生成(CO2)
c.氣體的密度不變 d.![]() 的比值不變
的比值不變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com