
 SO2和NOx在化學工業上有重要用途,也是大氣污染的主要來源,開發和利用并重,預防和治理并舉是當前工業上和環境保護領域研究的主要課題之一.
SO2和NOx在化學工業上有重要用途,也是大氣污染的主要來源,開發和利用并重,預防和治理并舉是當前工業上和環境保護領域研究的主要課題之一.分析 (1)①根據平衡常數只受溫度的影響判斷;
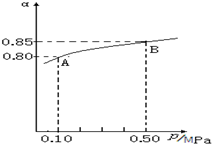
②由圖象可知壓強為0.10MPa時SO2的為80%,根據三段式計算各物質的平衡濃度,再計算反應速率和平衡常數;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根據蓋斯定律$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此計算反應熱,結合元素的化合價變化計算轉移的電子數.
解答 解:(1)①平衡常數只受溫度的影響,平衡狀態由A變到B時,溫度沒改變,則k(A)=k(B);
故答案為:=;
②由圖象知,體系總壓強為0.10MPa時SO2的平衡轉化率為0.8,根據三段式:
2SO2(g)+O2(g)$?_{△}^{催化劑}$2SO3(g)
起始量:2.0mol 1.0mol 0
轉化量:1.6mol 0.8mol 1.6mol
平衡量:0.4mol 0.2mol 1.6mol
則這一段時間內SO2的平均反應速率為$\frac{1.6mol÷10L}{40s}$=0.0040mol•L-1•s-1;該反應的平衡常數為K=$\frac{(1.6mol÷10L)^{2}}{(0.4mol÷10L)^{2}×(0.2mol÷10L)}$=800L•mol-1;
故答案為:0.0040mol•L-1•s-1;800L•mol-1;
(2)①已知:ⅠCH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
ⅡCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根據蓋斯定律(Ⅰ+Ⅱ)÷2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,取標準狀況下4.48LCH4完全反應,則n(CH4)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
則整個過程中轉移的電子總數為:0.20mol×8mol=1.60mol;
故答案為:1.6mol;
②若全部為NO,則發生CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,放出的熱量為0.2mol×1160kJ•mol-1=232kJ,
若全部為NO2,則發生CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol,放出的熱量為0.2mol×867kJ/mol=173.4kJ,
則放出的總熱量Q的取值范圍是173.4kJ<Q<232kJ;
故答案為:173.4kJ<Q<232kJ.
點評 本題考查化學平衡及化學反應及能量,側重于學生的分析能力和計算能力的考查,為高頻考點,題目難度中等,本題易錯點為化學平衡常數的計算,注意計算過程的把握.


 一卷搞定系列答案
一卷搞定系列答案 名校作業本系列答案
名校作業本系列答案 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/K | 反應I | 反應II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的溶解性為難溶,則該物質的溶解度為0 | |
| B. | 某離子被沉淀完全是指該離子在溶液中的濃度為0 | |
| C. | 通過沉淀反應能將大部分雜質離子沉淀 | |
| D. | 難溶電解質的溶度積越小,溶解度越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com