
工業上常用含少量Al2O3的釩鐵礦(FeO·V2O5)堿熔法提取V2O5。簡要流程如下:

已知:①焙燒時Al2O3和V2O5都能與純堿反應,生成相對應的鈉鹽,同時放出CO2氣體
②常溫下物質的溶解度:NaVO3~21.2g/l00g水;HVO3~0.008g/l00g水
請回答:(1)請寫出釩鐵礦焙燒時,V2O5與純堿反應化學方程式____?????????????? 。
“浸出渣B”的主要成分可能是①??????? ;②_??? ___? ;③_??? ___;④____??? 。(寫化學式,可不填滿)
(2)生產中,不直接用H2SO4浸泡“燒渣A”獲取HVO3的原因是____???????????? 。
(3)“操作①”包括??????? 、洗滌、干燥。如果不洗滌,則產品中可能含有的金屬陽離子是?????? 、?????? 。下列裝置(部分夾持儀器省去)可用在實驗室進行“操作②”的是____? 。(填序號)

(4)NaVO3用于原油的脫硫技術,由V2O5溶于熱NaOH溶液中制取,反應的離子方程式為____????????????????????????????????????????????????????? 。
(1)V2O5 +Na2CO3  2NaVO3 +CO2?? (2分)
2NaVO3 +CO2?? (2分)
Fe2O3或Fe3O4,或者Fe2O3和Fe3O4????????????????????????? (3分)??
(2)H2SO4與NaVO3反應生成難溶的HVO3,HVO3包裹在一些燒渣的表面,阻礙了反應的進行,從而降低了HVO3產率,且使產生的HVO3不純。另外,鐵的氧化物會和硫酸反應生成鐵離子,增加干擾離子,消耗硫酸,浪費資源。(3分)
(3)過濾(1分)Na+、Al3+(2分)B (2分)
(4)V2O5? +2OH- 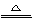 2VO3- + H2O? (2分)
2VO3- + H2O? (2分)
【解析】
試題分析:(1)根據V2O5能與純堿反應,生成相對應的鈉鹽,同時放出CO2氣體,得其化學方程式為V2O5 +Na2CO3  2NaVO3 +CO2?,在焙燒的過程中FeO被氧化為Fe2O3或Fe3O4,所以“浸出渣B”的主要成分可能是①Fe2O3②Fe3O4、③Fe2O3和Fe3O4
2NaVO3 +CO2?,在焙燒的過程中FeO被氧化為Fe2O3或Fe3O4,所以“浸出渣B”的主要成分可能是①Fe2O3②Fe3O4、③Fe2O3和Fe3O4
(2)若直接加入硫酸,則A中的鐵的氧化物與硫酸反應增加干擾離子,消耗硫酸,浪費資源;同時H2SO4與NaVO3反應生成難溶的HVO3,HVO3包裹在一些燒渣的表面,阻礙了反應的進行,從而降低了HVO3產率,且使產生的HVO3不純。
(3)加入硫酸后產生難溶的HVO3,所以需過濾出來;該過程中硫酸與偏鋁酸鈉反應最終生成鋁離子,所以若不洗滌沉淀,則可能含有Na+、Al3+,操作②是把HVO3進行受熱分解得V2O5,所以應選擇B裝置;
(4)V2O5溶于熱NaOH溶液中,產物之一是NaVO3,不難推測另一產物是水,所以反應的離子方程式為
V2O5? +2OH-  2VO3- + H2O
2VO3- + H2O
考點:考查化學中化學方程式、離子方程式的書寫,化學反應產物的判斷、分析,實驗步驟、裝置的判斷


科目:高中化學 來源: 題型:閱讀理解

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
 [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+ [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||


| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
2+ 4 |
- 3 |
查看答案和解析>>
科目:高中化學 來源:2013屆江蘇省蘇南四校高三12月月考試化學試卷(帶解析) 題型:填空題
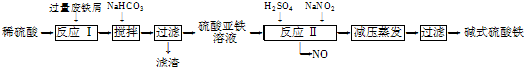
(12分)堿式硫酸鐵[Fe(OH)SO4]是一種用于污水處理的新型高效絮凝劑,在醫藥上也可用于治療消化性潰瘍出血。工業上利用廢鐵屑(含少量氧化鋁、氧化鐵等)生產堿式硫酸鐵的工藝流程如下:
已知:部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省蘇南四校高三12月月考試化學試卷(解析版) 題型:填空題
(12分)堿式硫酸鐵[Fe(OH)SO4]是一種用于污水處理的新型高效絮凝劑,在醫藥上也可用于治療消化性潰瘍出血。工業上利用廢鐵屑(含少量氧化鋁、氧化鐵等)生產堿式硫酸鐵的工藝流程如下:

已知:部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
開始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列問題:
(1)工業上常用一定濃度的純堿溶液清洗鐵屑,目的是 。
(2)加入少量NaHCO3的目的是調節溶液的pH至 a,a的范圍是 。
(3)已知室溫下,Al(OH)3的Ksp=1.3×10-33,當pH=5時,溶液中c(Al3+)=
(4)在實際生產中,反應Ⅱ常同時通入O2以減少NaNO2的用量,若參與反應的O2有11.2L(標準狀況),則相當于節約NaNO2的物質的量為 ;O2參與反應的離子方程式為
(5)堿式硫酸鐵溶于水后產生的Fe(OH)2+離子,可部分水解生成Fe2(OH)42+聚合離子。該水解反應的離子方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com