
【題目】在硫酸、明礬和硫酸鋁組成的混合溶液中,![]() ,
,![]() ,由水電離的
,由水電離的![]() ,則
,則![]() 為
為
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】B
【解析】
由水電離的c(H+)水=10-13molL-1,根據水電離的氫離子和氫氧根離子濃度相等,所以c(OH-)水=c(H+)水=10-13molL-1,根據Kw=c(OH-)c(H+),代入c(OH-)水=10-13molL-1,則溶液中c(H+)=0.1mol/L,且c(Al3+)=0.3molL-1,c(SO42-)=0.7molL-1,根據電荷守恒有c(H+)+3c(Al3+)+c(K+)=2c(SO42-)+ c(OH-),c(OH-)=10-13molL-1可忽略,故c(K+)=2c(SO42-)-c(H+)-3c(Al3+)=2×0.7mol/L-0.1mol/L-3×0.3mol/L=0.4mol/L,
故選:D。


科目:高中化學 來源: 題型:
【題目】GaN是制造5G芯片的材料,氮化鎵鋁和氮化鋁LED可發出紫外光。回答下列問題:
(1)基態As原子核外電子排布式為[Ar]____________;下列狀態的鋁元素中,電離最外層的一個電子所需能量最小的是______________(填標號)。
A.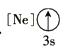 B.
B.![]() C.
C.![]() D.
D.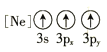
(2)8—羥基喹啉合鋁(分子式C27H18AlN3O3)用于發光材料及電子傳輸材料,可由LiAlH4與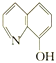 8—羥基喹啉)合成。LiAlH4中陰離子的空間構型為______________; 8—羥基喹啉合鋁中所含元素電負性最大的是______________(填元素符號,下同),第一電離能最大的是__________(填元素符號),N原子的雜化方式為_____________。
8—羥基喹啉)合成。LiAlH4中陰離子的空間構型為______________; 8—羥基喹啉合鋁中所含元素電負性最大的是______________(填元素符號,下同),第一電離能最大的是__________(填元素符號),N原子的雜化方式為_____________。
(3)已知下列化合物的熔點:
化合物 | AlF3 | GaF3 | AlCl3 |
熔點/℃ | 1040 | 1000 | 194 |
①表格中鹵化物的熔點產生差異的原因是_______________________________________________。
②熔融AlCl3時可生成具有揮發性的二聚體Al2Cl6分子,分子中每個原子最外層均達到8電子,二聚體Al2Cl6的結構式為______________________________;其中Al的配位數為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A卷題.電子工業常用FeCl3溶液腐蝕絕緣板上的銅箔,制造印刷電路板。從腐蝕廢液(主要含FeCl3、FeCl2、CuCl2 )中回收銅,并重新獲得FeCl3溶液。廢液處理流程如下:
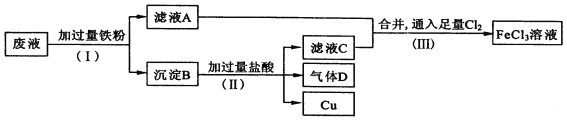
(1)步驟(Ⅰ)中分離溶液和沉淀的操作名稱是____________________;
(2)沉淀B中主要含有鐵和__________,氣體D是_________________;
(3)寫出步驟(Ⅲ)中生成FeCl3的化學方程式_____________________________;
(4)取少量最終所得溶液滴加____________(填“KSCN溶液”或“稀硫酸”),溶液呈紅色,證明有Fe3+存在;寫出該反應的離子方程式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )

下列圖示與對應的敘述符合的是( )
A.圖甲實線、虛線分別表示某可逆反應未使用催化劑和使用催化劑的正、逆反應速率隨時間的變化
B.圖乙表示反應2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常數K與溫度和壓強的關系
2SO3(g)△H<0的平衡常數K與溫度和壓強的關系
C.圖丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液時,溶液中 隨HCl溶液體積變化關系
隨HCl溶液體積變化關系
D.圖丁表示常溫下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH隨NaOH溶液體積的變化關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,正確的是
A.78g Na2O2固體含有離子的數目為4NA
B.由水電離出的c(H+)=1012mol·L1溶液中Na+、NH4+、SO42、NO3 一定能大量共存
C.硫酸酸化的KI淀粉溶液久置后變藍的反應為:4I+O2+4H+=2I2+2H2O
D.將充有NO2的玻璃球浸到熱水中氣體顏色加深說明2NO2(g)![]() N2O4(g) △H >0
N2O4(g) △H >0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蓋斯定律在生產和科學研究中有很重要的意義。有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定。現根據下列3個熱化學反應方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
寫出CO氣體還原FeO固體得到Fe固體和CO2氣體的熱化學反應方程式:
_________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下Fe2O3可被甲烷還原為“納米級”的金屬鐵,其反應:Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) ΔH,在容積固定且均為1L的Ⅰ、Ⅱ、Ⅲ三個相同密閉容器中加入足量“納米級”的金屬鐵,然后分別充入1molCO和2molH2,三個容器的反應溫度分別為T1、T2、T3(依次升高)且恒定不變,測得反應均進行到t min時CO的體積分數如圖所示。下列說法正確的是( )
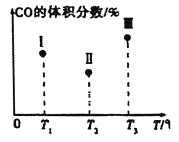
A.該反應的ΔH>0
B.容器Ⅲ中CO的體積分數可能為35%
C.容器中固體的質量不再改變,不能說明反應已達平衡狀態
D.反應進行到tmin時,三個容器中一定達到平衡狀態的是Ⅱ和Ⅲ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com