
分析 依據化學平衡常數概念,結合反應化學方程式書寫平衡常數;測得10min內v(ClNO)=7.5×10-3mol•L-1•min-1,則△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式計算參加反應NO、氯氣的物質的量,進而計算平衡時氯氣的物質的量、NO的轉化率;正反應為氣體物質的量減小的反應,恒溫恒容下條件下,到達平衡時壓強比起始壓強小,其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,等效為在恒溫恒容下的平衡基礎上增大壓強,平衡正向移動;
平衡常數只受溫度影響,溫度不變,平衡常數不變.
解答 解:2NO(g)+Cl2(g)?2ClNO(g),△H2<0 (Ⅱ),平衡常數K=$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$,在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2,10min時反應(Ⅱ)達到平衡,測得10min內v(ClNO)=7.5×10-3mol•L-1•min-1,物質的量為7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
變化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
則平衡后n(Cl2)=0.025mol,
NO的轉化率α1=$\frac{0.15mol}{.2mol}$×100%=75%;
其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,隨反應進行,氣體體積減小,為保持恒壓所以容器體積減小,壓強比恒容容器大,平衡正向進行,平衡時NO的轉化率α2 增大;平衡常數隨溫度變化,不隨濃度、壓強變化,若要使K2減小,平衡逆向進行,反應是放熱反應,依據平衡移動原理應升高溫度,平衡逆向進行;
故答案為:$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$;0.025;75%;>;不變;升高溫度.
點評 本題考查了化學平衡常數的計算,影響化學平衡的因素分析應用判斷,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
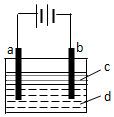 由于Fe(OH)2極易被氧化,所以實驗室難用亞鐵鹽溶液與燒堿反應制得白色純凈的Fe(OH)2沉淀.若用如圖所示實驗裝置可制得純凈的Fe(OH)2沉淀.兩極材料分別為石墨和鐵.
由于Fe(OH)2極易被氧化,所以實驗室難用亞鐵鹽溶液與燒堿反應制得白色純凈的Fe(OH)2沉淀.若用如圖所示實驗裝置可制得純凈的Fe(OH)2沉淀.兩極材料分別為石墨和鐵.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將30 mL 0.5 mol/L NaOH溶液加水稀釋到500 mL,所得溶液的NaOH的濃度為0.3 mol/L | |
| B. | 配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的濃H2SO4的體積約為13.9 mL | |
| C. | 0.270 kg質量分數為10%的CuCl2溶液中Cl-的物質的量為0.2 mol | |
| D. | 80 g NaOH溶于1 L水中所得的溶液的物質的量濃度為2 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a:b=3:1 | |
| B. | X、Y的轉化率相等 | |
| C. | Y和Z的生成速率之比為2:3可做平衡標志 | |
| D. | a的取值范圍為0 mol•L-1<a<0.18 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
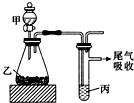
| 甲 | 乙 | 丙 | 結論 | |
| A | 水 | 電石 | 溴水 | 穩定性:H2O>C2H2>Br2 |
| B | 鹽酸 | 硫化亞鐵 | 溴水 | 還原性:Cl->Br->S2- |
| C | 濃鹽酸 | 高錳酸鉀 | 溴化鉀溶液 | 氧化性:高錳酸鉀>Cl2>Br2 |
| D | 鹽酸 | 石灰石 | 苯酚鈉溶液 | 酸性:HCl>H2CO3>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4-(綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答:
元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4-(綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com