
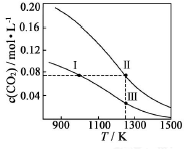
 在體積均為1.0L的恒容密閉容器中加入足量的相同的碳粉,再分別加入0.1molCO2和0.3molCO2,在不同溫度下反應CO2(g)+C(s)?2CO(g)達到平衡,平衡時CO2的物質的量濃度c(CO2)隨溫度的變化如圖所示(圖中Ⅰ、Ⅱ、Ⅲ點均處于曲線上).下列說法正確的是( )
在體積均為1.0L的恒容密閉容器中加入足量的相同的碳粉,再分別加入0.1molCO2和0.3molCO2,在不同溫度下反應CO2(g)+C(s)?2CO(g)達到平衡,平衡時CO2的物質的量濃度c(CO2)隨溫度的變化如圖所示(圖中Ⅰ、Ⅱ、Ⅲ點均處于曲線上).下列說法正確的是( )| A. | 反應CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 體系的總壓強P總:P總(狀態Ⅱ)>3P總(狀態Ⅰ) | |
| C. | 體系中c(CO2):c(CO2,狀態Ⅱ)<3c(CO2,狀態Ⅲ) | |
| D. | 逆反應速率V逆:V逆(狀態Ⅰ)>V逆(狀態Ⅲ) |
分析 A.由氣體的化學計量數增大可知△S,由圖中溫度高平衡時c(CO2)小可知△H;
B.分別加入0.1molCO2和0.3molCO2,曲線I為加入0.1molCO2,曲線II為加入0.2molCO2,加壓CO2(g)+C(s)?2CO(g)平衡逆向移動;
C.狀態II、狀態Ⅲ的溫度相同,狀態II看作先加入0.1molCO2,與狀態Ⅲ平衡時CO的濃度相同,再加入0.2molCO2,若平衡不移動,Ⅱ狀態CO的濃度等于3倍Ⅲ,但再充入CO2,相當增大壓強,平衡左移動,消耗CO;
D.狀態I、狀態Ⅲ的溫度不同,溫度高反應速率快.
解答 解:A.由氣體的化學計量數增大可知△S>0,由圖中溫度高平衡時c(CO2)小,則升高溫度平衡正向移動,可知△H>0,故A錯誤;
B.分別加入0.1molCO2和0.3molCO2,曲線I為加入0.1molCO2,曲線II為加入0.2molCO2,若平衡不移動,體系的總壓強為P總(狀態Ⅱ)=2P總(狀態Ⅰ),但加壓CO2(g)+C(s)?2CO(g)平衡逆向移動,為使c(CO2)相同,則加熱使平衡正向移動,則體系的總壓強為P總(狀態Ⅱ)>2P總(狀態Ⅰ),所以體系的總壓強P總:P總(狀態Ⅱ)>3P總(狀態Ⅰ),故B正確;
C.狀態II、狀態Ⅲ的溫度相同,狀態II看作先加入0.1molCO2,與狀態Ⅲ平衡時CO的濃度相同,再加入0.2molCO2,若平衡不移動,Ⅱ狀態CO的濃度等于3倍Ⅲ,但再充入CO2,相當增大壓強,平衡左移,消耗CO,則c(CO,狀態Ⅱ)<3c(CO,狀態Ⅲ),故C正確;
D.狀態I、狀態Ⅲ的溫度不同,溫度高反應速率快,則逆反應速率為V逆(狀態Ⅰ)<V逆(狀態Ⅲ),故D錯誤;
故選BC.
點評 本題考查化學平衡及平衡的建立,為高頻考點,題目難度中等,明確平衡移動的影響因素、圖象分析為解答的關鍵,選項BC為解答的難點,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| 反應時間/min | n(SO3)/mol | n(O2)/mol |
| 0 | 2.0 | 0 |
| 2 | 0.8 | |
| 4 | 0.6 | |
| 6 | 1.8 | 1.1 |
| A. | 0~2 min平均速率v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 4 min后,平衡移動的原因可能是減壓 | |
| C. | 若升高溫度后的平衡常數的值為1.0,則該正反應為吸熱反應 | |
| D. | 若起始時容器中SO3的物質的量改為1.0 mol,則平衡時n(SO2)=0.6 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 低溫、低壓 | B. | 低溫、高壓 | C. | 高溫、高壓 | D. | 高溫、低壓 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 在熔融電解質中,O2-由負極移向正極 | |
| B. | 電池的總反應是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空氣的一極是正極,電極反應為 O2+4e-=2O2- | |
| D. | 通入丁烷的一極是負極,電極反應為 C4H10+13O2-+26e-=4CO2+5H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化鐵可用來制造紅色油漆和涂料 | |
| B. | 生鐵、普通鋼和不銹鋼中的含碳量依次減小 | |
| C. | 硅膠可用作實驗室和袋裝食品、瓶裝藥品等的干燥劑 | |
| D. | 硅是生產光纖制品的基本原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com