
【題目】I、實驗室中常用MnO2氧化濃鹽酸的方法制取氯氣,實驗裝置如圖所示:
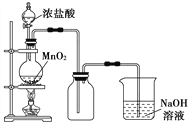
(1)圓底燒瓶中發生反應的化學反應方程式是__________________。
(2)如果將過量二氧化錳與20 mL 12 mol·L-1的鹽酸混合加熱(忽略鹽酸的揮發),充分反應后生成的氯氣明顯_________(填大于、等于、小于)0.06 mol。其主要原因有_____________________________;
(3)寫出尾氣處理的離子方程式是_______________________。
II、用Na2CO3·10H2O晶體,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)應稱取Na2CO3·10H2O晶體的質量:____________。定容時,向容量瓶中加水,至1~2cm時,改用_________加水至刻度,加蓋搖勻;
(2)下列操作對所配溶液的濃度可能產生影響
①Na2CO3·10H2O晶體失去了部分結晶水 ②用“左碼右物”的稱量方法稱量晶體(使用游碼) ③碳酸鈉晶體不純,其中混有氯化鈉 ④容量瓶未經干燥使用。 其中引起所配溶液濃度偏高的有______________(填序號)。
【答案】MnO2+4HCl( 濃)![]() MnCl2+Cl2↑+2H2O小于隨反應的進行,鹽酸濃度變小,稀鹽酸和二氧化錳不反應Cl2+2OH–=Cl–+ClO–+H2O28.6g膠頭滴管①
MnCl2+Cl2↑+2H2O小于隨反應的進行,鹽酸濃度變小,稀鹽酸和二氧化錳不反應Cl2+2OH–=Cl–+ClO–+H2O28.6g膠頭滴管①
【解析】試題分析:I、本題考查實驗室制取氯氣。(1)固體二氧化錳和濃鹽酸加熱反應得到氯氣;(2)二氧化錳與濃鹽酸反應生成氯氣,二氧化錳與稀鹽酸不反應;(3)氯氣能溶于氫氧化鈉溶液;II、本題考查用固體配制一定物質的量濃度的溶液的實驗步驟、配制480mL溶液需要500mL的容量瓶;誤差分析依據C(測)V(測)=C(標)V(標)分析;
解析:(1)圓底燒瓶中二氧化錳和濃鹽酸發生反應生成氯氣的反應方程式是MnO2+4HCl( 濃)![]() MnCl2+Cl2↑+2H2O ;(2) 二氧化錳與濃鹽酸反應生成氯氣,二氧化錳與稀鹽酸不反應,將過量二氧化錳與20 mL 12 mol·L-1的鹽酸混合加熱(忽略鹽酸的揮發),鹽酸變稀后不再反應,最終鹽酸有剩余,所以充分反應后生成的氯氣明顯小于0.06 mol。(3)用氫氧化鈉吸收氯氣生成氯化鈉、次氯酸鈉和水,離子方程式是Cl2+2OH– =Cl–+ClO–+H2O;
MnCl2+Cl2↑+2H2O ;(2) 二氧化錳與濃鹽酸反應生成氯氣,二氧化錳與稀鹽酸不反應,將過量二氧化錳與20 mL 12 mol·L-1的鹽酸混合加熱(忽略鹽酸的揮發),鹽酸變稀后不再反應,最終鹽酸有剩余,所以充分反應后生成的氯氣明顯小于0.06 mol。(3)用氫氧化鈉吸收氯氣生成氯化鈉、次氯酸鈉和水,離子方程式是Cl2+2OH– =Cl–+ClO–+H2O;
II、用Na2CO3·10H2O晶體,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)配制0.2 mol·L-1的Na2CO3溶液480 mL,需要500mL的容量瓶,應稱取Na2CO3·10H2O晶體的質量:0.2 mol·L-1×0.5L×286g/mol=28.6g。定容時,向容量瓶中加水,至1~2cm時,改用膠頭滴管加水至刻度,加蓋搖勻;
(2)①Na2CO3·10H2O晶體失去了部分結晶水,碳酸鈉質量偏大,所得溶液濃度偏高; ②用“左碼右物”的稱量方法稱量晶體(使用游碼),晶體質量小于28.6g,所得溶液濃度偏小; ③碳酸鈉晶體不純,其中混有氯化鈉,碳酸鈉質量偏小,所得溶液濃度偏小; ④容量瓶未經干燥使用,無影響。 所以 其中引起所配溶液濃度偏高的有①。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某酸性廢液中含有Fe2+、Cu2+、Ba2+三種金屬離子,有同學設計了下列方案對廢液進行處理(所加試劑均稍過量),以回收金屬,保護環境。

請回答:
(1)沉淀a中含有的單質是_________;
(2)沉淀b的化學式是__________;
(3)沉淀c的化學式是__________;
(4)溶液A與H2O2溶液在酸性條件下反應的離子方程式是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分(I)A、B、C、D、E、F、G均為短周期元素,原子序數依次遞增。A元素原子核內無中子,B元素原子最外層電子數是次外層電子數的2倍,D是地殼中含量最多的元素,E是短周期中金屬性最強的元素.F與G位置相鄰.G是同周期元素中原子半徑最小的元素。
請用化學用語回答:
(1)A與D形成的18電子的化合物與FD2化合生成一種強酸,寫出該強酸酸式鈉鹽水溶液的電離方程式為:________________。
(2)用電子式表示化合物E2D的形成過程:________________。
(3)在l0lkPa、25℃下,14g氣態B2A4在D2中完全燃燒,放出QkJ熱量,則B2A4的燃燒熱的熱化學方程式為:________________。
(Ⅱ)A、B、C、X均為常見的純凈物,它們之間有如下轉化關系(副產品已略去)
![]()
試同答:
(4)若X是強氧化性單質,則A不可能是___________。
a.H,S b. NH3c.Na d.Zn e.CH3CH2OH
(5)若X是金屬單質,向C的水溶液中滴入AgNO3溶液,產生不溶于稀HNO3的白色沉淀,則C的化學式為________________。
(6)若A、B、C為含某金屬元素的無機化合物,X為強電解質,A溶液與C溶液反應生成B,則B的化學式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫下,將Xmol N2 和Ymol H2的混合氣體通入一個固定容積的密閉容器中,發生如下反應:N2(g)+3N2(g)![]() 2NH3(g)
2NH3(g)
⑴若反應進行到t時刻,n(N2)=10mol,n(NH3)=4mol,計算X的值。
⑵反應達到平衡時,混合氣體的體積為672L(標準狀況下),其中NH3的體積分數為20%,計算N2的轉化率和Y的值。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列物質轉化中,A是一種酸式鹽,D的相對分子質量比C的相對分子質量大16,E是酸,當X無論是強酸還是強堿時,都有如下的轉化關系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
當X是強酸時,A、B、C、D、E均含同一種元素;當X是強堿時,A、B、C、D、E均含另外同一種元素。請回答:
(1)A是________, Z是________。
(2)當X是強酸時,寫出B生成C的化學方程式:___________________。
(3)當X是強堿時,E是________,寫出E和銅反應生成C的化學方程式:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列變化屬于吸熱反應的是( )
①液態水汽化②將膽礬加熱變為白色粉末③濃硫酸稀釋④氯酸鉀分解制氧氣⑤生石灰跟水反應生成熟石灰
A.①④⑤ B.①②④ C.②③ D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中錯誤的是
A. 根據對角線規則,鈹和鋁的性質具有相似性
B. [Cu(H2O)4]2+中Cu提供空軌道,H2O中O提供孤對電子形成配位鍵
C. 元素電負性越大的原子,吸引電子的能力越強
D. 手性分子互為鏡像,它們的性質沒有區別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的兩塊鈉,第一塊在足量氧氣中加熱,第二塊在足量氧氣(常溫)中充分反應,則下列說法正確的是( )
A. 第一塊鈉失去電子多
B. 兩塊鈉失去電子一樣多
C. 第二塊鈉的反應產物質量最大
D. 第二塊鈉的反應產物在空氣中更穩定
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com