
 隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.
隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.濃度/mol•L-1 時間/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
分析 (1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根據蓋斯定律,(①+②+3×4)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);
(2)SO2轉化為SO42-該過程為氧氣氧化二價鐵離子到三價鐵離子,然后用三價鐵離子氧化二氧化硫到硫酸根離子;
(3)①根據v=$\frac{△c}{△t}$計算v(CO2)
②20min處于平衡狀態,根據K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$計算平衡常數;
③一定溫度下,隨著NO的起始濃度增大,等效為增大壓強,不影響平衡移動;
④可逆反應到達平衡時,同種物質的正逆速率相等,各組分的濃度、含量保持不變,由此衍生的其它一些量不變,判斷平衡的物理量應隨反應進行發生變化,該物理量由變化到不變化說明到達平衡;
⑤30min~40min之間,NO濃度減小0.08mol/L,N2濃度增大0.04mol/L,CO2濃度減小0.13mol/L,應是減小二氧化碳的濃度,瞬間減小二氧化碳的濃度為(0.3+0.04)mol/L-0.17mol/L=0.17mol/L,平衡時濃度為0.17mol/L.
解答 解:(1)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根據蓋斯定律,(①+②+3×4)÷2可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1,
故答案為:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1;
(2)常溫下將SO2轉化為SO42-而實現SO2的處理.含SO2的廢氣通入含Fe2+、Fe3+的溶液時其中一個反應的離子方程式為:4Fe2++O2+4H+═4Fe3++2H2O,則另一反應的離子方程式為三價鐵離子氧化二氧化硫到硫酸根離子,反應的離子方程式為:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案為:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①10min~20min以v(CO2) 表示的反應速率=$\frac{0.3mol/L-0.21mol/L}{20min-10min}$=0.009 mol•L-1•min-1,故答案為:0.009 mol•L-1•min-1;
②20min處于平衡狀態,平衡常數K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56,
故答案為:0.56;
③一定溫度下,隨著NO的起始濃度增大,等效為增大壓強,不影響平衡移動,則NO的平衡轉化率不變,
故答案為:不變;
④A.反應是氣體體積不變的反應,反應過程中容器內壓強數值保持不變,故A錯誤;
B.當v正(NO)=2v逆(N2)反應達到平衡,故B錯誤;
C.容器內CO2的體積分數不變,說明反應達到平衡,故C正確;
D.混合氣體密度等于質量除以體積,反應中碳是固體,平衡移動氣體質量變化,體積不變,隨反應進行混合氣體密度增大,混合氣體的密度保持不變說明反應達到平衡,故D正確;
故選:CD;
⑤30min~40min之間,NO濃度減小0.08mol/L,N2濃度增大0.04mol/L,CO2濃度減小0.13mol/L,應是減小二氧化碳的濃度,瞬間減小二氧化碳的濃度為(0.3+0.04)mol/L-0.17mol/L=0.17mol/L,該瞬間二氧化碳濃度為0.13mol/L,平衡時濃度為0.17mol/L,則30min至40minCO2濃度的變化曲線圖象為,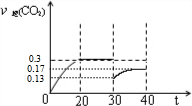 ,故答案為:減小CO2 的濃度;
,故答案為:減小CO2 的濃度; .
.
點評 本題考查化學平衡計算與影響因素、平衡狀態判斷、平衡常數、反應速率、熱化學方程式書寫等,(3)中作圖為易錯點,注意二氧化碳的瞬間濃度與平衡濃度.


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 濃度為0.06mol/L.
濃度為0.06mol/L.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 時 數 據 | CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | a kJ | b kJ | c kJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3具有還原性 | B. | H-是很強的還原劑 | ||
| C. | H2是氧化產物,NH2$_2^-$是還原產物 | D. | 該反應屬于置換反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com