
【題目】合成藥物X、Y和高聚物Z,可以用烴A為主要原料,采用以下路線:

已知:I.反應①、反應②均為加成反應。
II.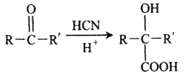
請回答下列問題:
(1)A的結構簡式為_____________。
(2)Z中的官能團名稱為____________,反應③的條件為___________.
(3)關于藥物Y(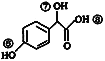 )的說法正確的是____________。
)的說法正確的是____________。
A.1mol藥物Y與足量的鈉反應可以生成33.6 L氫氣
B.藥物Y的分子式為C8H8O4,能使酸性高錳酸鉀溶液褪色
C.藥物Y中⑥、⑦、⑧三處-OH的活潑性由強到弱的順序是⑧>⑥>⑦
D.1mol藥物Y與H2、濃溴水中的Br2反應,最多消耗分別為4 mol和2 mol
(4)寫出反應E→F的化學方程式______________________________________。F→X的化學方程式______________________________________________。
(5)寫出符合下列條件的E的一種同分異構體的結構簡式_______________。
①遇FeCl3溶液可以發生顯色反應,且是苯的二元取代物;
②能發生銀鏡反應和水解反應;
③核磁共振氫譜有6個峰。
(6)參考上述流程以CH3CHO和CH3OH為起始原料,其它無機試劑任選設計合成Z的線路___________________________________________。
【答案】CH≡CH 酯基 NaOH水溶液、加熱 B、C 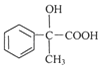 +C2H5OH
+C2H5OH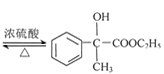 +H2O
+H2O 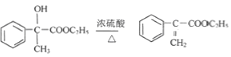 +H2O
+H2O ![]() 或
或 CH3CHO
CH3CHO 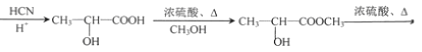 CH2=CHCOOCH3
CH2=CHCOOCH3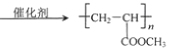
【解析】
反應①、反應②的原子利用率均為100%,屬于加成反應,結合反應②的產物,可知烴A為HC≡CH,B為![]() ,而G的相對分子質量為78,則G為
,而G的相對分子質量為78,則G為![]() .C可以發出催化氧化生成D,D發生信息中I的反應,則反應③為鹵代烴在氫氧化鈉水溶液、加熱條件下發生的水解反應,則C為
.C可以發出催化氧化生成D,D發生信息中I的反應,則反應③為鹵代烴在氫氧化鈉水溶液、加熱條件下發生的水解反應,則C為![]() ,D為
,D為![]() ,E為
,E為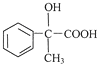 ,F為
,F為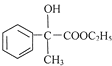 ,F在濃硫酸、加熱條件下發生消去反應得到X。乙醛與HCN發生加成反應、酸性條件下水解得到
,F在濃硫酸、加熱條件下發生消去反應得到X。乙醛與HCN發生加成反應、酸性條件下水解得到![]() ,與甲醇反應酯化反應生成
,與甲醇反應酯化反應生成![]() ,在濃硫酸、加熱條件下發生消去反應生成CH2=CHCOOCH3,最后發生加聚反應得到
,在濃硫酸、加熱條件下發生消去反應生成CH2=CHCOOCH3,最后發生加聚反應得到![]() ,以此解答該題。
,以此解答該題。
(1)由以上分析可知A為CH≡CH;
(2)由Z的結構簡式可知Z含有酯基,反應③為鹵代烴的水解,條件為:氫氧化鈉水溶液、加熱;
(3)A.羥基、羧基能與鈉反應生成氫氣,1mol藥物Y與足量的鈉反應可以生成1.5mol氫氣,標況下氫氣體積為33.6L,但氫氣不一定處于標況下,故A錯誤;B.藥物Y的分子式為C8H804,含有酚羥基,能使酸性高錳酸鉀溶液褪色,故B正確;C.羧基酸性最強,酚羥基酸性很弱,醇羥基表現為中性,藥物Y中⑥、⑦、⑧三處-OH的電離程度由大到小的順序是⑧>⑥>⑦,故C正確;D.苯環與氫氣發生加成反應,1mol藥物Y與3molH2加成,Y中酚羥基的鄰位能與濃溴水發生取代反應,1molY消耗2molBr2,故D錯誤;故答案為B、C;
(4)反應E-F的化學方程式: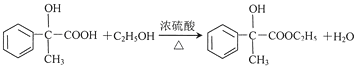 ,F→X的化學方程式為
,F→X的化學方程式為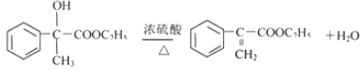 ;
;
(5)E為![]() ,對應的同分異構體①遇FeCl3溶液可以發生顯色反應,說明含有酚羥基,且是苯的對位二元取代物;②能發生銀鏡反應和水解反應,應為甲酸酯類;③核磁共振氫譜有6個峰,則可能的結構為
,對應的同分異構體①遇FeCl3溶液可以發生顯色反應,說明含有酚羥基,且是苯的對位二元取代物;②能發生銀鏡反應和水解反應,應為甲酸酯類;③核磁共振氫譜有6個峰,則可能的結構為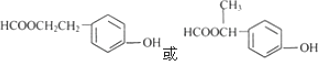 ;
;
(6)以CH3CHO和CH3OH為起始原料,合成Z,可用乙醛與HCN發生加成反應,然后水解生成2-羥基丙酸,與甲醇發生酯化反應,再發生消去反應,最后發生加聚反應生成Z,也可用乙醛與HCN發生加成反應,然后水解生成2-羥基丙酸,發生消去反應生成丙烯酸,與甲醇發生酯化反應,最后發生加聚反應生成Z,對應的流程可為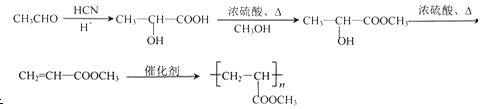 或者
或者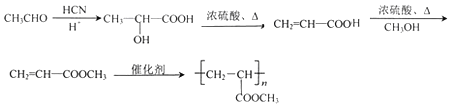 。
。


科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
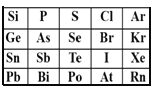
A. 穩定性:HBr<HI<Hat
B. 酸性:H3PO4<H2SO4<HClO4
C. 原子半徑:Sn>As>S
D. 表中,元素Pb的金屬性最強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在NaCN溶液中存在水解平衡:CN-+H2O![]() HCN+OH-,水解常數
HCN+OH-,水解常數![]() [co(NaCN)是NaCN溶液的起始濃度]。25℃向1mol/L的NaCN溶液中不斷加水稀釋,NaCN溶液濃度的對數值lgc0與2pOH[p0H=-lgc(0H-)]的關系下圖所示,下列說法錯誤的是
[co(NaCN)是NaCN溶液的起始濃度]。25℃向1mol/L的NaCN溶液中不斷加水稀釋,NaCN溶液濃度的對數值lgc0與2pOH[p0H=-lgc(0H-)]的關系下圖所示,下列說法錯誤的是

A. 25℃時,Kn(CN-)的值為10-4.7
B. 升高溫度,可使曲線上a點變到b點
C. 25℃,向a點對應的溶液中加入固體NaCN,CN-的水解程度減小
D. c點對應溶液中的c(OH-)大于a點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將0.10mol·L-1鹽酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH隨加入鹽酸體積變化曲線如圖所示。已知:pOH=-lg c(OH-),下列說法正確的是

A. M點所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N點所示溶液中c(NH4+)>c(Cl-)
C. Q點消耗鹽酸的體積等于氨水的體積
D. M點和N點所示溶液中水的電離程度相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. HF、HCl、HBr、HI的熔沸點依次升高
B. CH4、CCl4都是含有極性鍵的非極性分子
C. CS2、H2S、C2H2都是直線形分子
D. 氯的各種含氧酸的酸性由強到弱排列為HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4既是一種重要的能源,也是一種重要的化工原料。
(1)甲烷的電子式為__。
(2)甲烷高溫分解生成氫氣和碳。在密閉容器中進行此反應時要通入適量空氣使部分甲烷燃燒,其目的是__。
(3)以CH4為燃料可設計成結構簡單、能量轉化率高、對環境無污染的燃料電池,其工作原理如圖所示,則通入a氣體的電極名稱為__,通入b氣體的電極反應式__。(質子交換膜只允許H+通過)

(4)在一定溫度和催化劑作用下,CH4與CO2可直接轉化成乙酸,這是實現“減排”的一種研究方向。
①在不同溫度下,催化劑的催化效率與乙酸的生成速率如圖所示,則該反應的最佳溫度應控制在__左右。
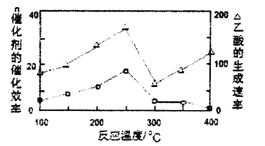
②該反應催化劑的有效成分為偏鋁酸亞銅(CuAlO2,難溶物)。將CuAlO2溶解在稀硝酸中生成兩種鹽并放出NO氣體,其離子方程式為__。
(5)CH4還原法是處理NOx氣體的一種方法。已知一定條件下CH4與NOx反應轉化為N2和CO2,若標準狀況下8.96LCH4可處理22.4LNOx,則x值為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用工業廢堿渣(主要成分Na2CO3)吸收硫酸廠尾氣中的SO2制備無水Na2SO3的流程如下:

下列說法錯誤的是( )
A. 向大氣中排放SO2可能導致酸雨發生
B. 中和器中發生反應的離子方程式為HSO3-+OH-= SO32-+H2O
C. 檢驗Na2SO3成品中是否含Na2SO4,可選用稀鹽酸和Ba(NO3)2溶液
D. 進入離心機的分散系是懸濁液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電滲析法是一種利用離子交換膜進行海水淡化的方法,其原理如圖所示,電極為惰性電極。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等離子。下列敘述中正確的是( )

A. A膜是陽離子交換膜
B. 通電后,海水中陰離子往b電極處移動
C. 通電后,b電極上產生無色氣體,溶液中出現白色沉淀
D. 通電后,a電極的電極反應式為4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機反應中,與其它三個反應的反應類型不同的是
A. CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B. 2CH3COOH+Mg = (CH3COO)2Mg+H2↑
C. CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
D. ![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com