
【題目】現有前四周期T、X、Y、Z、W、M六種元素,已知W、Z、X、T、Y五種非金屬元素原子半徑依次減小,其中W原子的s電子總數等于p電子總數的2倍,M原子的M能層上有4個未成對電子。請回答下列問題:
(1)寫出W、Z、X、T四種元素第一電離能由大到小的順序:____________(用元素符號表示)。
(2)基態M原子的核外電子排布式為__________________________。
(3)根據VSEPR理論,推斷出由W與X兩元素組成的最簡單二價陰離子的立體構型為____________,W原子的雜化類型為____________。
(4)Y與T、X、Z、W所形成的最簡單化合物的沸點由高到低的順序為__________________________(用化學式表示)。
【答案】)F>N>O>C 1s22s22p63s23p63d64s2(或[Ar]3d64s2) 平面三角形 sp2 H2O>HF>NH3>CH4
【解析】
根據題中信息“W原子的s電子總數等于p電子總數的2倍”可知,W的電子排布式是1s22s22p2,則W是碳元素;又知“W、Z、X、T、Y五種非金屬元素原子半徑依次減小”,根據元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氫元素;“M原子的M能層上有4個未成對電子”,則M的電子排布式是1s22s22p63s23p63d64s2,即M是鐵元素。
(1)C、N、O、F四種元素位于同一周期,隨原子序數增大,第一電離能呈增大趨勢,但N元素反常,它的第一電離能比O大,但比F小。
(2) 基態M原子的核外電子排布式為1s22s22p63s23p63d64s2或[Ar] 3d64s2;
(3)C和O兩種元素組成的最簡單的二價陰離子是![]() ,該離子的中心原子的價層電子對數是3,孤電子對數是0,由此可確定其立體構型和雜化類型。
,該離子的中心原子的價層電子對數是3,孤電子對數是0,由此可確定其立體構型和雜化類型。
(4)H與F、O、N、C所形成的最簡單化合物分別是HF、H2O、NH3、CH4,其中HF、H2O、NH3分子之間都存在氫鍵,它們的沸點都比沒有氫鍵的CH4高,常溫下H2O為液態,HF、NH3為氣態,標準狀況下HF為液態,NH3仍為氣態,由此可得四種氫化物的沸點由高到低的順序。
根據題中信息“W原子的s電子總數等于p電子總數的2倍”可知,W的電子排布式是1s22s22p2,則W是碳元素;又知“W、Z、X、T、Y五種非金屬元素原子半徑依次減小”,根據元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氫元素;“M原子的M能層上有4個未成對電子”,則M的電子排布式是1s22s22p63s23p63d64s2,即M是鐵元素。
(1)C、N、O、F四種元素位于同一周期,隨原子序數增大,第一電離能呈增大趨勢,但N元素反常,因此第一電離能由大到小的順序是F>N>O>C;答案為:F>N>O>C;
(2) 基態M原子的核外電子排布式為1s22s22p63s23p63d64s2;答案為:1s22s22p63s23p6或[Ar] 3d64s2;
(3)C和O兩種元素組成的最簡單的二價陰離子是![]() ,該離子的中心原子的價層電子對數是3,孤電子對數是0,因此其立體構型是平面三角形,C原子的雜化類型為sp2雜化。
,該離子的中心原子的價層電子對數是3,孤電子對數是0,因此其立體構型是平面三角形,C原子的雜化類型為sp2雜化。
(4)H與F、O、N、C所形成的最簡單化合物分別是HF、H2O、NH3、CH4,其中HF、H2O、NH3分子之間都存在氫鍵,它們的沸點都比沒有氫鍵的CH4高,常溫下H2O為液態,HF、NH3為氣態,標準狀況下HF為液態,NH3仍為氣態,因此四種氫化物的沸點由高到低的順序為H2O>HF>NH3>CH4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】向葡萄酒中加入Na2S2O5抗氧化。測定某葡萄酒中Na2S2O5殘留量的方法:取50.00ml葡萄酒樣品,用0.0100molL-1的碘標準液滴定至終點,消耗標準液10.00ml。則該樣品中Na2S2O5的殘留量為![]() 已知
已知![]()
![]()
A.0.001gL-1B.0.002gL-1C.0.064gL-1D.0.19gL-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.電離平衡常數可以表示弱電解質的相對強弱
B.電離平衡常數受溶液濃度的影響
C.H2CO3的電離常數表達式:K=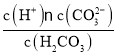
D.電離常數大的酸溶液中c(H+)一定比電離常數小的酸中大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物結構簡式為![]() ,下列敘述不正確的是( )
,下列敘述不正確的是( )
A.1mol該有機物在加熱和催化劑作用下,最多能和4molH2反應
B.該有機物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.該有機物在一定條件下能發生消去反應或取代反應
D.該有機物遇硝酸銀溶液產生白色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀氨水中存在著下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反應方向移動,同時使c(OH-)增大,應加入的物質或采取的措施是
NH4++OH-,若要使平衡向逆反應方向移動,同時使c(OH-)增大,應加入的物質或采取的措施是
①NH4Cl固體;②硫酸;③NaOH固體;④水;⑤加熱;⑥加入少量MgSO4固體。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(選修3:物質結構與性質)
工業上用合成氣(CO和H2)制取乙醇的反應為2CO+4H2![]() CH3CH2OH+H2O。研究發現,使用TiO2作為載體負載銠基催化劑具有較高的乙醇產量。回答下列問題:
CH3CH2OH+H2O。研究發現,使用TiO2作為載體負載銠基催化劑具有較高的乙醇產量。回答下列問題:
(1)Ti基態原子核外電子排布式為_______。和O同一周期且元素的第一電離能比O大的有_____(填元素符號),和O同一周期且基態原子核外未成對電子數比O多的有____(填元素符號)。
(2)在用合成氣制取乙醇反應所涉及的4種物質中,沸點從低到高的順序為______________。
(3)工業上以CO、O2、NH3為原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ鍵與π鍵的數目之比為_________。
(4)C元素與N元素形成的某種晶體的晶胞如圖所示(8個碳原子位于立方體的頂點,4個碳原子位于立方體的面心,4個氮原子在立方體內),該晶體硬度超過金剛石,成為首屈一指的超硬新材料。
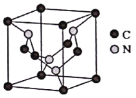
①該晶體的化學式為______;其硬度超過金剛石的原因是___________。
②已知該晶胞的密度為d g/cm3,N原子的半徑為r1cm,C原子的半徑為r2cm,設NA為阿伏加德羅常數,則該晶胞的空間利用率為__________________(用含d、r1、r2、NA的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以鉻鐵礦(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)為原料制取鉻酸鈉(Na2CrO4)晶體,其工藝流程如下:

已知:①+3價Cr在酸性溶液中性質穩定,當pH>9時以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
②常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
開始沉淀時的pH | 1.9 | 7.0 | 9.1 | — | — |
沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 4.7(>10溶解) | 5.6(>9溶解) |
(1)提高酸浸速率的措施有__________________________________(答兩條)。
(2)濾渣1的主要成分是_____;濾渣2的主要成分是_____;濾渣3的主要成分是_____。
(3)流程中兩次使用了H2O2進行氧化,H2O2的電子式為___________;第一次氧化時反應的離子方程式為_____________________;第二次氧化時目的是____________________。
(4)流程圖中“ ”內的操作是________________、洗滌、干燥。
(5)除去酸性廢水中含有的Cr2O72-可以使用FeSO4,測得反應后的溶液中含Cr3+、Fe2+、Fe3+、H+等陽離子。該反應的離子方程式為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學方程式或離子方程式正確的是( )
A.用醋酸去除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.甲醛與足量新制Cu(OH)2濁液反應:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O
HCOOH+Cu2O↓+2H2O
C.實驗室用液溴和苯在催化劑作用下制溴苯:![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.將CO2通入苯酚鈉溶液:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3)可以除去自來水中的氯氣,在水產養殖上被廣泛應用。用純堿和硫化堿(主要成分Na2S,含少量Na2SO4、Na2CO3等)為原料制備Na2S2O3·5H2O的實驗流程如下:
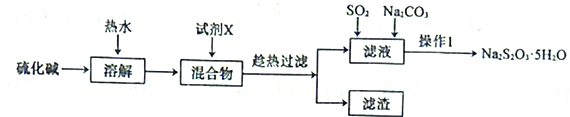
回答下列問題:
(1)試劑X是一種二元化合物的鋇鹽,它與Na2SO4反應的化學方程式為___________________。
(2)用熱水溶解并趁熱過濾的目的是______________________。
(3)利用SO2與Na2CO3、Na2S的混合溶液反應制備Na2S2O3,所需儀器如下圖:
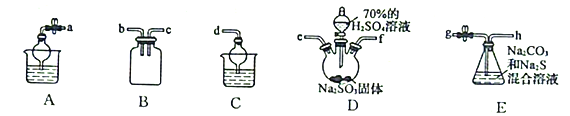
①從左到右連接各儀器,導管的接口順序為:___________接e、f接___________、___________接___________、___________接d。___________
②E中發生反應的離子方程式為______________________。
③裝置B的作用是______________________。
(4)操作1包括蒸發濃縮、______________________、___________、洗滌、干燥
(5)為測定產品Na2S2O3·5H2O的純度,準確稱取12.4gNa2S2O3·5H2O產品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示劑,用0.2500mol·L-1碘的標準溶液滴定,發生反應2S2O32-+I2= S4O62-+2I-,消耗碘的標準溶液20.00mL,則該產品的純度為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com