
【題目】天宮二號空間實驗室于2016年9月15 日在酒泉衛星發射中心發射成功。實驗室承載了10余項太空實驗,其中包含了好比科幻英維“綜合材料”多晶碲化鋅(ZnTe)的實驗。
(1)電負性Zn___________Te(填“>”或“<”或“=”)。
(2)O、S、Se與Te元素位于同一主族。基態碲(Te)原子核外電子排布式為[Kr]________,有_______個未成對電子。
(3)H2O、H2S、H2Se沸點由低到高順序為______,推斷的依據是_______;SO2分子中S原子采取_____雜化;用價層電子對互斥理論解釋SO42-的鍵角大于SO32-的原因是____________。
(4)向氯化鋅溶液中加入過量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化學鍵有共價鍵、____、_______。
(5)碲化鋅晶體有兩種結構,其中一種晶胞結構如下圖:

晶胞中含有_____個Te原子;與Te原子距離最近的Te原子有______個;若兩個距離最近的Te原子間距為apm.則晶體密度為_________g/cm3。
【答案】 < 4d105s25p4 2 H2S<H2Se<H2O 水分子之間能形成氫鍵,因此沸點最高,相對分子質量H2S<H2Se,分子間作用力H2S<H2Se,因此沸點H2S<H2Se<H2O sp2 兩種離子的中心硫原子均為sp3雜化 SO42-中沒有孤對電子,SO42-有一對孤對電子,孤電子對對成鍵電子有排斥作用,因此鍵角更小 離子鍵 配位鍵 4 12 ![]()
【解析】試題分析:(1) 一般來說,非金屬元素電負性大于1.8,金屬元素小于等于1.8;碲(Te)原子核外電子比Kr多16個,排布在4d、5s、5p能級;5p能級上有2個未成對電子;(3)同主族元素的氫化物,相對分子質量越大,沸點越高,水分子之間能形成氫鍵,因此沸點最高,;SO2分子中S原子的價電子對數是![]() ;SO42-、SO32-中S原子的價電子對數是
;SO42-、SO32-中S原子的價電子對數是![]() ,SO42-中沒有孤對電子、SO32-有1對孤對電子;(4) [Zn(NH3)4]Cl2中[Zn(NH3)4]2+、Cl-之間是離子鍵、Zn2+與NH3之間是配位鍵、NH3中N原子與H原子之間是共價鍵;(5)根據均攤原則計算晶胞中Te原子個數;根據晶胞結構分析與Te原子距離最近的Te原子數;若兩個距離最近的Te原子間距為apm,則晶胞邊長是
,SO42-中沒有孤對電子、SO32-有1對孤對電子;(4) [Zn(NH3)4]Cl2中[Zn(NH3)4]2+、Cl-之間是離子鍵、Zn2+與NH3之間是配位鍵、NH3中N原子與H原子之間是共價鍵;(5)根據均攤原則計算晶胞中Te原子個數;根據晶胞結構分析與Te原子距離最近的Te原子數;若兩個距離最近的Te原子間距為apm,則晶胞邊長是![]() ,根據均攤原則晶胞中含有Zn原子數4,含有Te原子
,根據均攤原則晶胞中含有Zn原子數4,含有Te原子![]() ,晶胞的化學式是Zn4Te4,所以晶胞的摩爾質量是772g/mol。
,晶胞的化學式是Zn4Te4,所以晶胞的摩爾質量是772g/mol。
解析:(1) 一般來說,非金屬元素電負性大于1.8,金屬元素小于等于1.8,所以電負性Zn<Te;碲(Te)原子核外電子比Kr多16個,排布在4d、5s、5p能級,基態碲(Te)原子核外電子排布式為[Kr] 4d105s25p4;5p能級上有2個未成對電子;(3)相對分子質量H2S<H2Se,分子間作用力H2S<H2Se,因此沸點H2S< H2Se,水分子之間能形成氫鍵,因此沸點最高,所以H2O、H2S、H2Se沸點由低到高順序為H2S<H2Se<H2O;SO2分子中S原子的價電子對數是![]() ,S原子采取sp2雜化;SO42-、SO32-中S原子的價電子對數是
,S原子采取sp2雜化;SO42-、SO32-中S原子的價電子對數是![]() ,兩種離子的中心硫原子均為sp3雜化,SO42-中沒有孤對電子,SO32-有一對孤對電子,孤電子對對成鍵電子有排斥作用,因此鍵角更小;(4) [Zn(NH3)4]Cl2中[Zn(NH3)4]2+、Cl-之間是離子鍵、Zn2+與NH3之間是配位鍵、NH3中N原子與H原子之間是共價鍵,此配位化合物中含有的化學鍵有共價鍵、離子鍵、配位鍵;(5)根據均攤原則,晶胞中Te原子個數為
,兩種離子的中心硫原子均為sp3雜化,SO42-中沒有孤對電子,SO32-有一對孤對電子,孤電子對對成鍵電子有排斥作用,因此鍵角更小;(4) [Zn(NH3)4]Cl2中[Zn(NH3)4]2+、Cl-之間是離子鍵、Zn2+與NH3之間是配位鍵、NH3中N原子與H原子之間是共價鍵,此配位化合物中含有的化學鍵有共價鍵、離子鍵、配位鍵;(5)根據均攤原則,晶胞中Te原子個數為![]() ;根據晶胞結構,與Te原子距離最近的Te原子同層有4個、上下兩層各4個,共12個;若兩個距離最近的Te原子間距為apm,則晶胞邊長是
;根據晶胞結構,與Te原子距離最近的Te原子同層有4個、上下兩層各4個,共12個;若兩個距離最近的Te原子間距為apm,則晶胞邊長是![]() ,根據均攤原則晶胞中含有Zn原子數4,含有4個Te原子,晶胞的化學式是Zn4Te4,所以晶胞的摩爾質量是772g/mol;晶胞的密度是
,根據均攤原則晶胞中含有Zn原子數4,含有4個Te原子,晶胞的化學式是Zn4Te4,所以晶胞的摩爾質量是772g/mol;晶胞的密度是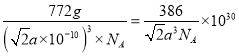 g/cm3。
g/cm3。


科目:高中化學 來源: 題型:
【題目】已知:H2(g)+Cl2(g) ![]() 2HCl(g)反應的能量變化示意圖如下:
2HCl(g)反應的能量變化示意圖如下:

下列說法正確的是
A. 點燃條件和光照條件下,反應的ΔH不同
B. 反應的ΔH約為[2c- (a+b)]kJ·mol-1
C. “假想的中間物質”的總能量低于起始態H2和Cl2的總能量
D. 反應涉及的物質中,既有含極性鍵的物質,也有含非極性鍵的物質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組探究鋁片做電極材料時的原電池反應,設計下表中裝置進行實驗并記錄。
【實驗1】
裝置 | 實驗現象 |
| 左側裝置電流計指針向右偏轉,燈泡亮 右側裝置電流計指針向右偏轉,鎂條、鋁條表面產生無色氣泡 |
(1)實驗1中,電解質溶液為鹽酸,鎂條做原電池的________極。
【實驗2】
將實驗1中的電解質溶液換為NaOH溶液進行實驗2。
(2)該小組同學認為,此時原電池的總反應為2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,據此推測應該出現的實驗現象為________。
2NaAlO2 + 3H2↑,據此推測應該出現的實驗現象為________。
實驗2實際獲得的現象如下:
裝置 | 實驗現象 |
| i.電流計指針迅速向右偏轉,鎂條表面無氣泡,鋁條表面有氣泡 ⅱ.電流計指針逐漸向零刻度恢復,經零刻度后繼續向左偏轉。鎂條表面開始時無明顯現象,一段時間后有少量氣泡逸出,鋁條表面持續有氣泡逸出 |
(3)i中鋁條表面放電的物質是溶解在溶液中的O2,則該電極反應式為________。
(4)ii中“電流計指針逐漸向零刻度恢復”的原因是________。
【實驗3和實驗4】
為了排除Mg條的干擾,同學們重新設計裝置并進行實驗3和實驗4,獲得的實驗現象如下:
編號 | 裝置 | 實驗現象 |
實驗3 |
| 電流計指針向左偏轉。鋁條表面有氣泡逸出,銅片沒有明顯現象;約10分鐘后,銅片表面有少量氣泡產生,鋁條表面氣泡略有減少。 |
實驗4 |
煮沸冷卻后的溶液 | 電流計指針向左偏轉。鋁條表面有氣泡逸出,銅片沒有明顯現象;約3分鐘后,銅片表面有少量氣泡產生,鋁條表面氣泡略有減少。 |
(5)根據實驗3和實驗4可獲得的正確推論是________ (填字母序號)。
A. 上述兩裝置中,開始時銅片表面得電子的物質是O2
B. 銅片表面開始產生氣泡的時間長短與溶液中溶解氧的多少有關
C. 銅片表面產生的氣泡為H2
D. 由“鋁條表面氣泡略有減少”能推測H+在銅片表面得電子
(6)由實驗1~實驗4可推知,鋁片做電極材料時的原電池反應與________等因素有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】資料顯示:鋅與濃硫酸共熱除生成二氧化硫氣體外,還可能產生氫氣;在加熱的條件下二氧化硫可被CuO氧化。為驗證該反應的氣體產物及性質,設計了如下圖所示的實驗裝置(設鋅與濃硫酸共熱時產生的氣體為X)。

(1)上述裝置的連接順序為:氣體X→A→____→A→ → → →D;
(2)反應開始后,觀察到第一個裝置A中的品紅溶液褪色,實驗結束后取適量該溶液于試管中并加熱,現象為_______________________________________;
(3)裝置 C中的NaOH溶液能用下列____代替;
a.酸性KMnO4溶液 b.CaCl2溶液 c.飽和NaHSO3溶液
裝置D的作用是____________________________
(4)氣體X中可能含有H2的原因是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A. 向飽和NaCl溶液中1:1通入NH3和CO2制備NaHCO3
B. 500℃左右比通常狀況下更有利于合成氨
C. 實驗室中常用排飽和食鹽水的方法收集氯氣
D. 工業上生產硫酸的過程中使用過量的空氣以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容積為1L的密閉容器中通入1mol CO2和3mol H2,發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有關說法正確的是
CH3OH(g)+H2O(g) ΔH<0。下列有關說法正確的是
A. 該反應在高溫下才能自發進行
B. 再加入一定量CO2,則n(CH3OH)/n(CO2)減小
C. 溫度升高,反應的平衡常數K增大
D. 當CO2和H2轉化率相等時,該反應達到化學平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D均為中學化學常見物質,且均含有同一種元素,它們之間有如下轉化,其中A是單質。
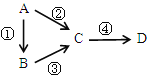
(1)若C是淡黃色固體常用于呼吸面具中的供氧劑,D是一種強堿。則C作供氧劑時與CO2反應的化學方程式為_______________________;其中還原劑是________,氧化產物是___________,7.8g C參加反應時轉移的電子數是___________。
(2)若B、D既能溶于強酸溶液,又能溶于強堿溶液,反應②③均需要強堿性溶液,反應④可以通過滴加少量稀鹽酸實現。據此寫出A元素的原子結構示意圖是______。請寫出A用于焊接鐵軌的化學方程式___________________________。請寫出②的離子方程式_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫時,Mg(OH)2的溶度積常數Ksp=5.6×10-12,取適量的MgCl2溶液,加入一定量的燒堿溶液達到沉淀溶解平衡,測得pH=13.0,則下列說法不正確的是( )
A. 所得溶液中的c(H+)=1.0×10-13 mol·L-1
B. 所得溶液中由水電離產生的c(H+)=1.0×10-13 mol·L-1
C. 所加的燒堿溶液pH=13.0
D. 所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳是主要的溫室氣體,也是一種工業原料。將其固定及利用,有利于緩解溫室效應帶來的環境問題。
(1)用二氧化碳合成甲醇。
已知:2H2(g)+O2(g)=2H2O(g) △H1=-484 kJ/mol
2CH3OH(g) +3O2(g)=2CO2(g)+4H2O(g) △H2=-1348 kJ/mol
在催化劑作用下,CO2(g)和H2(g)反應生成CH3OH(g)和H2O(g),該反應的熱化學方程式是________。
(2)用二氧化碳合成低密度聚乙烯(LDPE)。以納米二氧化鈦膜為工作電極,常溫常壓電解CO2,可制得LDPE,該電極反應可能的機理如下圖所示。

① 過程Ⅰ~Ⅲ中碳元素均發生________反應(填“氧化”或“還原”)。
② CO2轉化為LDPE的電極反應式是(補充完整并配平)________
2n CO2 + □________ +□________= ![]() + □________。
+ □________。
③工業上生產1.4×104 kg 的LDPE,理論上需要標準狀況下CO2的體積是______L。
(3)用二氧化碳與環氧丙烷(![]() )反應合成可降解塑料PPC,同時也能生成副產物CPC,其化學反應過程中的能量變化如下圖所示;在不同溫度和壓強下,PPC的選擇性(產物中PPC的質量與產物總質量的比值)和總產率(產物總質量與反應物投料總質量的比值)如下表所示。
)反應合成可降解塑料PPC,同時也能生成副產物CPC,其化學反應過程中的能量變化如下圖所示;在不同溫度和壓強下,PPC的選擇性(產物中PPC的質量與產物總質量的比值)和總產率(產物總質量與反應物投料總質量的比值)如下表所示。

①通過表中數據ⅰ、ⅱ、ⅲ可以得出的結論是________;在25℃時,實際生產中選擇反應壓強為1.5MPa,而不是2.0MPa,理由是________。
②通過表中數據ⅱ、ⅳ、ⅴ可知溫度升高會使PPC的選擇性下降,結合上圖說明其原因可能是______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com