
【題目】銅版畫的一種制版方法。以瀝青涂于薄銅板表面作防腐膜,用刀刻去防腐膜作畫,然后放在FeCl3腐蝕液中。刮去膜之處被腐蝕,形成凹線。印刷時凹線可儲油墨,在銅版機紙壓制下油墨吸于紙上,形成典雅、莊重的銅版畫。

(1)寫出FeCl3腐蝕銅板的離子方程式___________________
(2)下列措施可以加快銅板的腐蝕速率的有____________(填編號)
A. 加熱 B. 加氯化銅 C. 加少量碳粉 D. 加鹽酸
(3)通常不采用加快腐蝕速率的原因是_________________
(4)除去瀝青防腐膜后版即形成。可用________除去防腐膜(填編號)
A. 飽和Na2CO3溶液 B. 煤油 C. 酸液 D.堿液
(5)實驗室用固體氯化鐵配置FeCl3溶液的簡單操作是_____________
(6)腐蝕后的廢液(酸性)中加入NaNO3,產生NO氣體,寫出發生反應的離子方程式,并注明電子轉移的方向和數目:__________________________
(7)要驗證腐蝕后的廢液中含有Fe3+,可在溶液中加入試劑_________,現象_______________
【答案】 Cu+2Fe3+==Cu2++2Fe2+ AC 反應速率過快不易控制凹線的質量,從而影響版畫的質量 B 將固體氯化鐵溶于濃鹽酸中,再加水稀釋 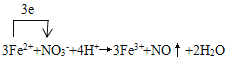 KSCN溶液 溶液呈血紅色
KSCN溶液 溶液呈血紅色
【解析】(1)氯化鐵具有氧化性,因此FeCl3腐蝕銅板的離子方程式為Cu+2Fe3+→Cu2++2Fe2+;(2) A. 加熱反應速率加快,A正確;B. 加氯化銅銅離子濃度增大,不利于反應,B錯誤;C. 加少量碳粉與銅構成原電池,加快反應速率,C正確;D. 鹽酸與銅不反應,D錯誤,答案選AC;(3)由于反應速率過快不易控制凹線的質量,從而影響版畫的質量,因此通常不采用加快腐蝕速率;(4)瀝青屬于有機物,應該用煤油溶解,答案選B;(5)氯化鐵水解,所以實驗室用固體氯化鐵配置FeCl3溶液的簡單操作是將固體氯化鐵溶于濃鹽酸中,再加水稀釋;(6)酸性溶液中硝酸根能把亞鐵離子氧化,自身被還原為NO,反應的離子方程式為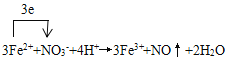 ;(7)要驗證腐蝕后的廢液中含有Fe3+,可在溶液中加入KSCN溶液,現象是溶液呈血紅色。
;(7)要驗證腐蝕后的廢液中含有Fe3+,可在溶液中加入KSCN溶液,現象是溶液呈血紅色。


科目:高中化學 來源: 題型:
【題目】鎂是一種重要的金屬資源,在各領域都具有重要的作用。
(1)皮江法煉鎂是我國生產鎂的重要方法,其實質是在高溫和真空條件下,有氧化鈣存在時,通過硅還原氧化鎂生成鎂蒸氣,與反應生成的固體硅酸二鈣(2CaO·SiO2)相互分離,并經冷凝得到結晶鎂。寫出該反應的化學反應方程式 。
電解槽中先得到的是鎂的蒸氣,鎂蒸氣可以在下列 (填編號)氣體氛圍中冷卻。
A.空氣 B.氮氣 C.水蒸氣 D.氫氣
(2)目前發達國家80%的鎂來自于電解熔融氯化鎂。電解原料無水氯化鎂可由海水制備。主要有以下步驟:①在干燥的HCl氣流中加熱脫水干燥;②加熟石灰;③加鹽酸;④過濾;⑤濃縮冷卻結晶。
其步驟先后順序是_____________________(步驟可重復使用);在干燥的HCl氣流中加熱時,能得到無水MgCl2,其原因是______________________。
(3)已知某溫度下Mg(OH)2的Ksp=6.4×l012,當溶液中c(Mg2+)≤1.0×105mol·L1可視為沉淀完全,則此溫度下應保持溶液中c(OH-)≥_______________mol·L1。
(4)在Mg(OH)2懸濁液中滴入飽和NH4Cl溶液,溶液變澄清。反應原因可能有兩個:一是NH4+水解產生H+,H+再與Mg(OH)2反應;二是_____________________(用離子方程式表示)。要驗證誰是Mg(OH)2溶解的主要原因,可選取________代替NH4Cl溶液作對照實驗。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(5)鎂電池是近年來科學技術研究的熱點之一,下圖為Mg—NaClO燃料電池結構示意圖。其工作時Mg作 (填“X”或“Y”)電極,正極的電極反應式: 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某分子的球棍模型如下圖所示。已知分子中所有原子的最外層均達到8電子穩定結構,原子間以單鍵相連。下列有關說法中錯誤的是( )
![]()
A. X原子可能為第ⅤA族元素
B. Y原子一定為第ⅠA族元素
C. 該分子中既含有極性共價鍵又含有非極性共價鍵
D. 從圓球的大小分析,該分子可能為N2F4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在工農業生產中具有重要作用。
完成下列填空:

(1)如圖所示為元素周期表中氮元素部分信息,數據“14.01”表示的是____________;氮原子最外層電子有________種不同的能量,有_______種不同運動狀態。
(2)NH3可以作制冷劑,是因為________________NH4Cl溶液與NaOH溶液混合至中性,則c(Na+)_______c(NH3H2O)(填“<,>”或“=”)
(3)寫出一個能比較氮、氧兩種元素非金屬性強弱的事實:________________
研究NO2、SO2、CO等大氣污染物的處理具有重要意義。NO2可用下列反應來處理:
![]()
(4)寫出上述反應的平衡常數表達式_______________增大該反應平衡常數的措施有__________(填編號)
A. 增壓 B. 增加NH3的濃度 C. 降溫 D. 及時移走產物
(5)一定條件下上述反應在某體積固定的密閉容器中進行,能說明該反應已經達到平衡狀態的是__________。(填編號)
A. c(NO2) : c(NH3)=3:4 B. ![]()
![]()
C. 容器內氣體總壓強不再變化 D. 容器內氣體密度不再變化
(6)某溫度下,在一個容積為2升的反應容器內,上述反應2分鐘后達到平衡,測試NO2減少了0.75mol,則在2分鐘內NH3的平均反應速率為: ![]() =_____________
=_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧乙酸(CH3COOOH)有強氧化性,用于物體表面、皮膚、果蔬、環境的消毒,其制備反應為:CH3COOH+H2O2![]() CH3COOOH+H2O,下列有關說法正確的是
CH3COOOH+H2O,下列有關說法正確的是
A. 增大壓強可加快該反應速率
B. 加入合適的催化劑可改變該反應的反應熱
C. 達到平衡時,用任意組分表示正逆反應速率都有v(正)=v(逆)
D. 達到平衡時,H2O2轉化率為100%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將純鋅片和純銅片按圖方式插入同濃度的稀硫酸中一段時間,以下敘述正確的是

A. 兩燒杯中銅片表面均無氣泡產生
B. 甲中銅片是正極,乙中銅片是負極
C. 兩燒杯中溶液的pH均增大
D. 甲、乙溶液均變藍色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于苯(下圖所示)的敘述正確的是( )

A. 反應②不發生,但是仍有分層現象,紫色層在下層
B. 反應①常溫下能進行,其有機產物為![]()
C. 反應③為加成反應,產物是三硝基甲苯
D. 反應④中1mol苯最多與3 mol H2發生加成反應,是因為苯分子含有三個碳碳雙鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】4P(紅磷s)![]() P4(白磷s) △H = +17kJmol﹣1根據以上方程式,下列推論正確的是
P4(白磷s) △H = +17kJmol﹣1根據以上方程式,下列推論正確的是
A. 正反應是一個放熱反應
B. 當lmol白磷完全轉變成紅磷時放出17kJ熱量
C. 當4g紅磷轉變成白磷時吸收17kJ熱量
D. 白磷比紅磷穩定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于石油和石油化工的說法錯誤的是( )
A. 石油的主要成分是碳氫化合物
B. 石油分餾得到的各餾分仍是混合物
C. 石油裂解氣的主要成分是甲烷
D. 石油裂化的目的是為了提高輕質油的產量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com