
分析 (1)干冰中碳原子與氧原子之間形成2對共用電子對;
(2)由題目信息可知,CO2與NH3反應生成NH2COONH4;
(3)NH2COONH4轉化為CO(NH2)2,由原子守恒可知還生成H2O;
(4)CO2中碳元素化合價為+4價,具有氧化性,H2具有還原性;
(5)NaHCO3、Fe與H2O反應可生成CH4,C元素發生還原反應,則Fe發生氧化反應生成四氧化三鐵,還應有NaOH生成;
(6)一份固體加入減輕的質量為結晶水的質量及碳酸氫鈉分解生成的二氧化碳、水的質量質量之和;另一份加入酸后用石灰水吸收氣體,生成的10g白色沉淀為碳酸鈣的質量,結合每份樣品總質量列方程計算解答;
(7)BaSO4與碳酸鈉反應得到BaCO3與硫酸鈉.
解答 解:(1)干冰中碳原子與氧原子之間形成2對共用電子對,結構式為O=C=O,
故答案為:O=C=O;
(2)由題目信息可知,CO2與NH3反應生成NH2COONH4,反應方程式為:CO2+2NH3═NH2COONH4,
故答案為:CO2+2NH3═NH2COONH4;
(3)NH2COONH4轉化為CO(NH2)2,由原子守恒可知還生成H2O,反應方程式為:NH2COONH4 $\frac{\underline{\;\;△\;\;}}{\;}$ CO(NH2)2+H2O,
故答案為:NH2COONH4 $\frac{\underline{\;\;△\;\;}}{\;}$ CO(NH2)2+H2O;
(4)CO2中碳元素化合價為+4價,具有氧化性,H2具有還原性,所以從氧化還原反應的角度說明該推測具有一定的合理性,
故答案為:CO2中碳元素化合價為+4價,具有氧化性,H2具有還原性,所以從氧化還原反應的角度說明該推測具有一定的合理性;
(5)NaHCO3、Fe與H2O反應可生成CH4,C元素發生還原反應,則Fe發生氧化反應生成四氧化三鐵,還應有NaOH生成,反應方程式為:NaHCO3+3Fe+2H2O$\frac{\underline{\;高溫高壓\;}}{\;}$CH4+NaOH+Fe3O4,
故答案為:NaHCO3+3Fe+2H2O$\frac{\underline{\;高溫高壓\;}}{\;}$CH4+NaOH+Fe3O4;
(6)設11.30g礦物中Na2CO3、NaHCO3、H2O的物質的量分別為amol、bmol、cmol,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固體質量減少
2mol 62g
bmol 31b g
則31b+18c=11.3-7.95=3.35
另一份加入酸后用石灰水吸收氣體,生成的10g白色沉淀為碳酸鈣的質量,根據碳原子守恒則a+b=$\frac{10}{100}$=0.1
由樣品質量可得:106a+84b+18c=11.3,
聯立方程解得a=0.05、b=0.05、c=0.1,
故該礦物的化學式是Na2CO3•NaHCO3•2H2O,
故答案為:Na2CO3•NaHCO3•2H2O;
(7)BaSO4不溶于酸,若用飽和Na2CO3溶液處理可轉化為溶于酸的BaCO3,沉淀轉化反應的離子方程式是:BaSO4+CO32-=BaCO3+SO42-,
故答案為:BaSO4+CO32-=BaCO3+SO42-.
點評 本題考查混合物計算、化學方程式書寫、氧化還原反應、沉淀轉化等,是對學生綜合能力的考查,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| ① | ② | ③ |
| 將鐵釘放入硫酸銅溶液中 | 向硫酸亞鐵溶液中滴入幾滴氯水 | 將銅絲放入氯化鐵溶液中 |
| A. | 實驗①中鐵釘只做還原劑 | |
| B. | 實驗②中Fe2+既顯氧化性又顯還原性 | |
| C. | 實驗③中發生的是置換反應 | |
| D. | 上述實驗證明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
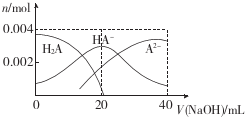
| A. | 當V(NaOH)=20 mL時,溶液中各離子濃度的大小順序為c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+) | |
| B. | 等體積等濃度的NaOH溶液與H2A溶液混合后,其溶液中水的電離程度比純水中的大 | |
| C. | 等濃度H2A和NaHA的混合溶液中無論加入少量的強酸或強堿,溶液的pH變化都不大 | |
| D. | 當V(NaOH)=40 mL時,升高溫度,$\frac{c(N{a}^{+})}{c({A}^{2-})}$減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
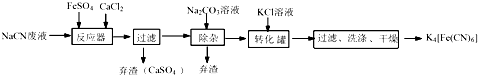
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4還原NO2至N2,則反應中放出的熱量一定為173.4kJ | |
| D. | 若用標準狀況下2.24 L CH4還原NO2至N2,整個過程中轉移的電子為0.8mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
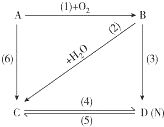 圖中A是一種金屬單質,B是淡黃色固體,D的焰色反應呈黃色;試指出A、B、C、D是何種物質,并寫出有關的化學方程式:
圖中A是一種金屬單質,B是淡黃色固體,D的焰色反應呈黃色;試指出A、B、C、D是何種物質,并寫出有關的化學方程式:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鋁溶液中加入過量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | NaHCO3溶液中加入鹽酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 向硫酸溶液中加入Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 偏鋁酸鈉溶液中通入過量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某課外興趣小組欲利用如圖所示裝置自制氫氧燃料電池.
某課外興趣小組欲利用如圖所示裝置自制氫氧燃料電池.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com