
【題目】元素是構成我們生活的世界中一切物質的“原材料”。
Ⅰ.1869年,門捷列夫在前人研究的基礎上制出了第一張元素周期表,如圖所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)門捷列夫將已有元素按照相對原子質量排序,同一_____(填“橫行”或“縱列”)元素性質相似。
(2)結合表中信息,猜想第5列方框中“Te=128?”的問號表達的含義是___________。
Ⅱ.X、Y、Z、W是現在元素周期表中的短周期元素,它們的相對位置如下圖所示,其中 Y 元素原子核外最外層電子數是其電子層數的3倍。
X | Y | |
Z | W |
請回答下列問題:
(1)W位于周期表中的位置____________________。
(2)比較Y、Z氣態氫化物的穩定性______________(用分子式表示)。
(3)科學家們認為存在含氫量最高的化合物XH5,預測其與水劇烈反應放出氣體,所得水溶液呈弱堿性,寫出該反應的化學方程式___________,XH5是離子化合物,它的電子式為________。
(4)工業上將干燥的W單質通入熔融的Z單質中可制得化合物Z2W2,該物質可與水反應生成一種能使品紅溶液褪色的氣體,0.2mol該物質參加反應時轉移0.3mol電子,其中只有一種元素化合價發生改變,寫出Z2W2與水反應的化學方程式_______________________________。
【答案】 橫行 懷疑Te的相對原子質量(或同一列相對原子質量依次增大,按此規律,Te的相對原子質量應該在122和127之間) 第三周期第ⅦA族 H2S<H2O NH5+H2O=H2↑+NH3·H2O  2S2Cl2+2H2O═3S↓+SO2↑+4HCl
2S2Cl2+2H2O═3S↓+SO2↑+4HCl
【解析】Ⅰ.(1) 結合表中信息得,給出的是元素的相對原子質量,故同一橫行元素性質相似;(2)結合表中信息,猜想第5列方框中“Te=128?”的問號表達的含義是懷疑Te的相對原子質量(或同一列相對原子質量依次增大,按此規律,Te的相對原子質量應該在122和127之間);Ⅱ.在短周期元素中,Y 元素原子核外最外層電子數是其電子層數的3倍,則Y是8號的O元素,根據元素在周期表中的相對位置關系可確定:X是N元素,Y是O元素;Z是S元素,W是Cl元素。(1)W是Cl元素,位于周期表中的位置第三周期第ⅦA族;(2)同主族從上而下非金屬性減弱,氣態氫化物的穩定性減弱,故Y、Z氣態氫化物的穩定性H2S<H2O;(3) X是N元素,科學家們認為存在含氫量最高的化合物XH5,即NH5,預測其與水劇烈反應放出氣體,所得水溶液呈弱堿性,該反應的化學方程式為NH5+H2O=H2↑+NH3·H2O,XH5是離子化合物,它的電子式為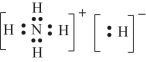 ;(4)化合物S2Cl2可與水反應生成一種能使品紅溶液褪色的氣體,該氣體為SO2,0.2mol該物質參加反應時轉移0.3mol電子,其中只有一種元素化合價發生改變,故S元素化合價降低,轉移0.3mol電子生成二氧化硫為0.1mol,故有0.3molS原子發生還原反應,根據電子轉移守恒可知S元素在還原產物中的化合價為0,故生成S,同時生成HCl,該反應的化學方程式為:2S2Cl2+2H2O═3S↓+SO2↑+4HCl。
;(4)化合物S2Cl2可與水反應生成一種能使品紅溶液褪色的氣體,該氣體為SO2,0.2mol該物質參加反應時轉移0.3mol電子,其中只有一種元素化合價發生改變,故S元素化合價降低,轉移0.3mol電子生成二氧化硫為0.1mol,故有0.3molS原子發生還原反應,根據電子轉移守恒可知S元素在還原產物中的化合價為0,故生成S,同時生成HCl,該反應的化學方程式為:2S2Cl2+2H2O═3S↓+SO2↑+4HCl。


 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 分子中共價鍵鍵能越高,鍵長越長,則分子越穩定
B. 元素周期表中的ⅡA族和ⅦA族元素的原子間不能形成共價鍵
C. 水分子可表示為H—O—H,分子中鍵角為180°
D. N—N、N===N、N≡N鍵能之比為1.00:2.17:4.90,說明N2分子中π鍵鍵能>σ鍵鍵能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列裝置進行實驗能達到相應實驗目的的是
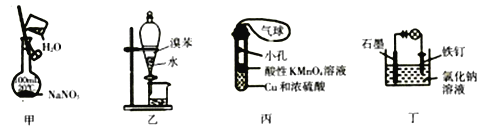
A. 用甲裝置配制一定物質的量濃度的NaNO3溶液
B. 用乙裝置分離溴苯和水
C. 用丙裝置制取SO2氣體并驗證其還原性(可加熱)
D. 用丁裝置防止鐵釘生銹
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A由碳、氫、氧三種元素組成。現取3 g A與 4.48 L氧氣(標準狀況)在密閉容器中燃燒,燃燒后生成二氧化碳、一氧化碳和水蒸氣(假設反應物沒有剩余)。將反應生成的氣體依次通過濃硫酸和堿石灰,濃硫酸增重3.6 g,堿石灰增重4.4 g。回答下列問題:
(1)通過計算確定該有機物的分子式___________________。
(2)若有機物A能與金屬鈉反應放出氫氣,請寫出有機物A可能的結構簡式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究大氣中含硫化合物(主要是H2S和SO2)的轉化具有重要意義。
(1)H2S資源化利用途徑之一是回收能量并得到單質硫,如圖為質子膜H2S燃料電池的示意圖。
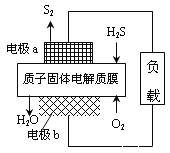
①電極a為電池的_______極,電極b上發生的電極反應為:______________________。
②每17gH2S參與反應,有_____molH+經質子膜進入_____極區。
(2)低濃度SO2廢氣的處理是工業難題,目前常用的方法如下:
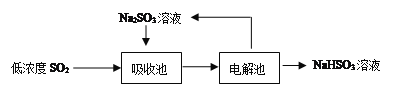
①Na2SO3溶液吸收SO2的化學方程式是____________________________________。
②如果用含等物質的量溶質的下列各溶液分別吸收SO2,則理論吸收量最多的是(____)
A.Na2SO3B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制一定體積、一定物質的量濃度的溶液,實驗結果產生偏高影響的是( )
A.容量瓶中原有少量蒸餾水
B.溶解所用的燒杯未洗滌
C.稱量時左碼右物
D.定容時俯視觀察液面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,反應H2(g)+CO2(g)H2O(g)+CO(g)的平衡常數K= ![]() .該溫度下在體積均為10L的三個密閉容器中分別加入反應物,起始加入量如圖所示:下列判斷不正確的是( )
.該溫度下在體積均為10L的三個密閉容器中分別加入反應物,起始加入量如圖所示:下列判斷不正確的是( )
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反應開始時,甲中的反應速率最慢,丙中的反應速率最快
B.平衡時,甲和丙中CO2的轉化率相等,均是60%
C.平衡時,乙中H2的轉化率大于60%
D.平衡時,丙中c(H2)是0.08 molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應屬于離子反應的是
A.氫氣還原氧化銅生成水和銅
B.石灰石高溫分解生成氧化鈣和二氧化碳
C.鹽酸滴加到石灰石固體上
D.實驗室加熱高錳酸鉀制氧氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氧化還原反應的敘述中,正確的是( )
A.一定有氧元素參加
B.氧化反應一定先于還原反應發生
C.氧化劑本身發生氧化反應
D.一定有電子轉移(得失或偏移)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com