
分析 A、用PH試紙檢驗溶液,發現溶液呈強酸性,則一定含H+,則一定不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性變為堿性,無沉淀產生,則一定不含Mg2+;
C、取少量B中的堿性溶液,滴加Na2CO3溶液,有白色沉淀產生,則白色沉淀為碳酸鋇,一定含Ba2+,則不含SO42-,以此來解答.
解答 解:A、用PH試紙檢驗溶液,發現溶液呈強酸性,則一定含H+,則一定不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性變為堿性,無沉淀產生,則一定不含Mg2+;
C、取少量B中的堿性溶液,滴加Na2CO3溶液,有白色沉淀產生,則白色沉淀為碳酸鋇,一定含Ba2+,則不含SO42-,由溶液顯中性,可知一定含Cl-,
①綜上所述,該溶液中肯定存在的離子有H+、Ba2+、Cl-,肯定不存在的離子有Mg2+、SO42-、CO32-,
故答案為:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-;
②C中發生反應的離子方程式為Ba2++CO32-=BaCO3↓,故答案為:Ba2++CO32-=BaCO3↓.
點評 本題考查常見離子的推斷,為高頻考點,把握離子反應與現象為解答的關鍵,側重分析與推斷能力的考查,注意電荷守恒及離子共存的應用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗操作 | |
| A | 制備Fe(OH)3膠體 | 將NaOH濃溶液滴加到飽和FeCl3溶液中 |
| B | 由MgCl2溶液制備無水MgCl2 | 將MgCl2溶液加熱蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸,過濾、洗滌、干燥 |
| D | 用CCl4萃取碘水中的I2 | 先從分液漏斗下口放出有機層,然后從上口倒出水層 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 三個反應均為放熱反應,故不需要加熱就能進行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃燒熱為764 kJ/mol | |
| D. | 若CO的燃燒熱為282.5 kJ/mol,則H2的燃燒熱為286 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用已知濃度的NaOH溶液測定H2SO4溶液的濃度,所選用的滴定管如圖甲、乙所示,從下表中選出正確選項( )
用已知濃度的NaOH溶液測定H2SO4溶液的濃度,所選用的滴定管如圖甲、乙所示,從下表中選出正確選項( )| 錐形瓶中的溶液 | 滴定管中的溶液 | 選用指示劑 | 選用滴定管 | |
| A. | 堿 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 堿 | 酚酞 | 甲 |
| C. | 堿 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 堿 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
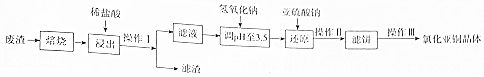
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
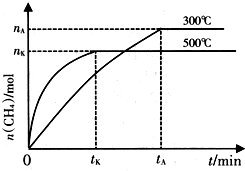 NH3和CO2是兩種重要的化工原料.
NH3和CO2是兩種重要的化工原料.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
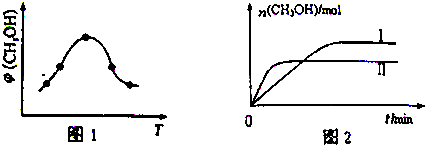
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com