
| A. | $\frac{22.4ab}{a{N}_{A}}$ | B. | $\frac{22.4ac}{b{N}_{A}}$ | C. | $\frac{22.4bc}{a{N}_{A}}$ | D. | $\frac{22.4b}{ac{N}_{A}}$ |
分析 計算cg氣體含有分子數目,再根據n=$\frac{N}{{N}_{A}}$計算cg氣體物質的量,根據V=nVm計算標準狀況下cg氣體的體積.
解答 解:a g某氣體中含有該氣體的分子數為b,則cg該氣體含有分子數目為:$\frac{cg}{ag}$×b=$\frac{bc}{a}$,
則cg該氣體的物質的量為:$\frac{\frac{bc}{a}}{{N}_{A}mo{l}^{-1}}$=$\frac{bc}{a{N}_{A}}$mol,
所以標況下cg該氣體的體積為:$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a{N}_{A}}$L,
故選C.
點評 本題考查了物質的量的計算,題目難度不大,明確物質的量與氣體摩爾體積、阿伏伽德羅常數之間的關系為解答關鍵,試題側重基礎知識的考查,培養了學生的化學計算能力.


 陽光課堂課時優化作業系列答案
陽光課堂課時優化作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,v(正)增大,v(逆)減小 | |
| B. | 增加C的量,反應速率增大,轉化率增大 | |
| C. | 恒溫恒壓,再充入N2,平衡不發生移動 | |
| D. | 恒溫恒容,再充入CO,最終逆反應速率增大,正反應速率也增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
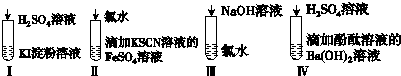
| 選項 | 現象 | 離子方程式 |
| A | I在空氣中放置一段時間后,溶液呈藍色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由淺綠色變為紅色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 顏色無變化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由紅色變無色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 編 號 | 往燒杯中加入的試劑及其用量(mL) | 催化劑 | 溶液開始變藍時間(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1雙氧水 | 0.1mol•L-1稀鹽酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 無 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 無 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 無 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 無 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
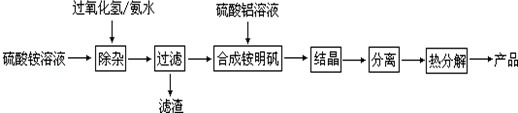
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 玻璃、水泥、水晶都是硅酸鹽制品 | |
| B. | 將秸稈焚燒可得富含鉀肥的草木灰,焚燒是一種較為理想的秸稈處理辦法 | |
| C. | 石油的分餾和煤的氣化、液化,涉及的都是物理變化 | |
| D. | 纖維素不能被人體消化吸收,但能促進腸道的蠕動,對人體有益 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com