
【題目】按要求回答下列問題
(1)若12.4 g Na2X中含有0.4 mol鈉離子,Na2X的摩爾質量是________,X的相對原子質量是________。
(2)標準狀況,1L 水中通入 aL HCl 氣體,忽略鹽酸溶液中 HCl的揮發,得到的鹽酸溶液密度為 b g/mL,則溶質的物質的量濃度為 __________mol/L
(3)某同學寫出以下化學方程式(未配平)NO+HNO3―→N2O3+H2O該應中氧化劑是________(寫化學式,下同) ;方程中出現的4種物質中還原性最強的物質是________。
【答案】62 g/mol 16 ![]() HNO3 NO
HNO3 NO
【解析】
(1)12.4 g Na2X中含有0.4 mol鈉離子,則Na2X的摩爾質量為![]() =62g/mol,由Na2X的相對分子質量為62可知,X的相對原子質量為(62—23×2)=16,故答案為62g/mol;16;
=62g/mol,由Na2X的相對分子質量為62可知,X的相對原子質量為(62—23×2)=16,故答案為62g/mol;16;
(2)標準狀況,aL HCl 氣體的物質的量為![]() mol,質量為
mol,質量為![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g,標準狀況,1L 水中通入 aL HCl 氣體得到溶液的質量為(1000+
g,標準狀況,1L 水中通入 aL HCl 氣體得到溶液的質量為(1000+![]() )g,溶液的體積為
)g,溶液的體積為![]() ×10—3L/ml,則溶質的物質的量濃度為
×10—3L/ml,則溶質的物質的量濃度為![]() =
=![]() mol/L,故答案為
mol/L,故答案為![]() ;
;
(3)由化學方程式可知,反應中NO中的N元素化合價升高被氧化,NO是還原劑,HNO3中的N元素化合價降低被還原,HNO3是氧化劑,N2O3即是氧化產物又作還原產物,由還原劑的還原性強于還原產物可知,還原性最強的是NO,故答案為HNO3;NO。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.1.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42-
B. pH =0的溶液:Al3+、CO32-、Cl-、SO42-
C.![]() 的溶液:K+、Ba2+、NO3-、Cl-
的溶液:K+、Ba2+、NO3-、Cl-
D.無色溶液:Na+、SO32-、Cu2+、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲線如圖。下列說法正確的是()
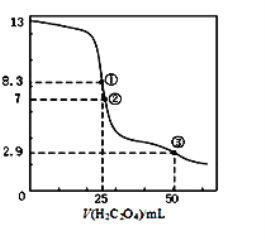
A.點①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.點②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.點③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定過程中可能出現:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)由N2、NO、CO2組成的混合氣體中,三種成分的體積分數之比為1:2:1,則三種成分的質量比為________。
(2)等質量的鈉和鎂分別與足量的稀硫酸反應,放出氣體的體積(同溫同壓)之比為________。
(3)同溫同壓下,某容器充滿CO2重122 g,充滿NO氣體重115 g,現充滿某氣體B重123 g,則該氣體的相對分子質量為_____。
(4)有15 g A物質和10.5 g B物質恰好完全反應生成7.2 g C物質、1.8 g D物質和0.3 mol E物質,則E物質的摩爾質量是_____g·mol-1。
(5)標準狀況下,10 mL N2氣體恰好與30 mL H2完全反應生成20 mL氣體A,則A的分子式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.56gN2與CO的混合物中原子總數是4NA
B.0.1mol/L的硫酸溶液中含H+的數目為0.2 NA
C.3mol單質Fe完全燃燒轉變為Fe3O4,Fe得到8NA個電子
D.標準狀況下,22.4LH2O所含的氧原子數目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是
A.將銅片插入稀硝酸中:![]()
B.稀硫酸與Ba(OH)2溶液反應:![]()
C.向A12(SO4)3溶液中加入過量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)甲醇一空氣燃料電池(DMFC)是一種高效能、輕污染的車載電池,其工作原理如圖甲所示,該電池中正極的電極反應式為_____。
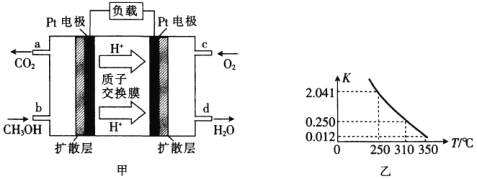
(2)工業上合成甲醇一般采用下列反應:![]() ,
,![]() ,圖乙是該反應在不同溫度下的化學平衡常數(K):
,圖乙是該反應在不同溫度下的化學平衡常數(K):
①由圖中數據判斷a_______0(填“>”“=”或“<”)。
②某溫度下,將2molCO和6molH2充入2L的恒容密閉容器中,充分反應達到平衡后,測得c(CO)=0.5mol·L-1,則此時的溫度為________℃。
(3)T℃時,在恒容密閉容器中發生反應:![]() ,各物質的濃度變化如圖丙所示:
,各物質的濃度變化如圖丙所示:
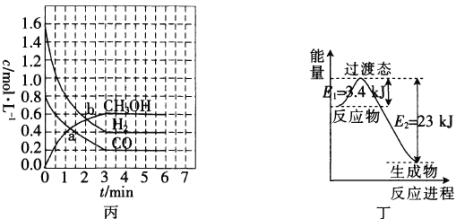
①反應從0min到3min之間,CH3OH的反應速率為________________。
②CO在0~1min和1~3min時平均反應速率[平均反應速率分別以v(0~1),v(1~3)表示]的大小為_____________________________。
(4)目前工業上有一種方法是用CO2和H2在230℃、催化劑條件下轉化生成甲醇蒸氣和水蒸氣。圖丁表示恒壓容器中0.5molCO2和1.5molH2反應時轉化率達80%的能量變化示意圖。寫出該反應的熱化學方程式:_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.某溫度時,在2L容器中A、B兩種物質間的轉化反應中A、B物質的量隨時間變化的曲線如圖所示,由圖中數據分析得:(8分鐘時A為0.2mol 、B為0.5mol)
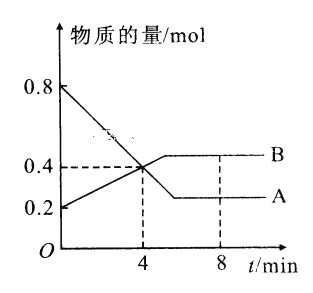
(1)該反應的化學方程式為_________________________。
(2)反應開始時至4min時,A的平均反應速率為________。
(3)4min時,反應是否達平衡狀態?________(填“是”或“否”), 8min時,V正________V逆(填“>”“<”或“=”)。
II.在2L密閉容器中,800℃時反應2NO(g)+O2(g) →2NO2(g)體系中,n(NO)隨時間的變化如表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反應________(填“是”或“不是”)可逆反應。
(2)如圖所示,表示NO2變化曲線的是________。
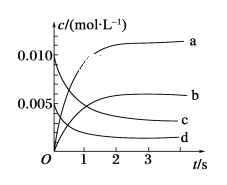
(3)能說明該反應已達到平衡狀態的是________(填序號)。
a. v(NO2)=2v(O2) b.容器內壓強保持不變
c. v逆(NO)=2v正(O2) d. 容器內密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物的轉化關系:C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3![]() CO2,其中涉及的基本反應類型依次是( )。
CO2,其中涉及的基本反應類型依次是( )。
A.化合、置換、分解、復分解
B.置換、復分解、化合、分解
C.置換、化合、復分解、分解
D.置換、化合、分解、復分解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com