
【題目】一種新型燃料電池,用兩根金屬Pt作電極插入KOH溶液中,然后向兩極分別通入甲烷和氧氣,其電極反應式為X極:CH4+10OH--8e-=CO32—+7H2O; Y極:4H2O+2O2+8e-=8OH-。下列關于此燃料電池的說法中,錯誤的是
A.X為負極,Y為正極
B.該電池工作時,X極附近溶液的堿性增強
C.在標準狀況下,通入 5.6 L O2完全反應后,有1 mol電子發生轉移
D.工作一段時間后,KOH的物質的量減少
【答案】B
【解析】
A.根據電極反應式X極:CH4+10OH--8e-═CO32-+7H2O,Y極:4H2O+2O2+8e-═8OH-可知,X極甲烷被氧化,應為原電池的負極反應,Y極氧氣得電子被還原,應為原電池的正極反應,故A正確;
B.根據電極反應式X極:CH4+10OH--8e-═CO32-+7H2O,可知反應消耗KOH,OH-濃度減小,則pH減小,堿性減弱,故B錯誤;
C.n(O2)=![]() ,轉移電子的物質的量為0.25mol×4=1mol,故C正確;
,轉移電子的物質的量為0.25mol×4=1mol,故C正確;
D.X極:CH4+10OH--8e-═CO32-+7H2O,Y極:4H2O+2O2+8e-═8OH-,則總反應:CH4+2O2+2OH-=CO32-+3H2O,氫氧化鉀被消耗,物質的量減小,故D正確;
故選:B。


科目:高中化學 來源: 題型:
【題目】砷及其化合物在半導體、農藥制造等方面用途非常廣泛。回答下列問題:
(1)ASH3的電子式為___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,該反應中氧化劑與還原劑的物質的量之比為___。
(2)改變O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物質的量分布分數隨pH的變化如圖所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示劑,用NaOH溶液滴定H3 ASO4發生的主要反應的離子方程式為___
②反應H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶煉砷的其中兩個熱化學反應如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
則反應4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代數式表示)。
H=_______kJ/mol(用含a、b的代數式表示)。
(4)反應2As2S3(s)=4AsS(g)+S2(g)達平衡時氣體總壓的對數值lg(p/kPa)與溫度的關系如圖所示:

①對應溫度下,B點的反應速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A點處,AsS(g)的分壓為___kPa,該反應的Kp=___kPa5 (Kp為以分壓表示的平衡常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H+、Na+、Al3+、Ba2+、OH-、![]() 、Cl-七種離子形成了甲、乙、丙、丁四種化合物,它們之間可以發生如下轉化關系(產物H2O未標出),下列說法不正確的是
、Cl-七種離子形成了甲、乙、丙、丁四種化合物,它們之間可以發生如下轉化關系(產物H2O未標出),下列說法不正確的是
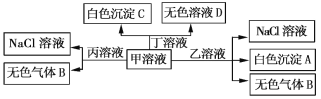
A. 白色沉淀A可能能溶解在溶液D中
B. 甲與丁可能發生反應:![]() +Ba2+ +OH-
+Ba2+ +OH-![]() BaCO3↓+H2O
BaCO3↓+H2O
C. 丙溶液與S2-、![]() 、
、![]() 可以大量共存
可以大量共存
D. 甲溶液中一定滿足:c(H2CO3)+c(H+)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用二氧化錳與濃鹽酸反應制備氯氣,并將Cl2通入較濃的NaOH和H2O2的混合液中。產生的ClO-被H2O2還原,發生激烈反應,產生較高能量的O2,隨即它又轉變為普通O2,并發出紅光。進行此項實驗所用主要儀器如下,請回答:

(1)氯氣發生器中的的儀器a的名稱是__。通過橡膠管將整套裝置連接起來的正確順序為:__。(用儀器的序號表示)
(2)實驗開始前,必做的一項操作是__。
(3)儀器①中ClO-與H2O2反應的離子方程式為__。
(4)儀器②中試劑的主要作用是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照給定元素的位置,回答下列問題:
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素④、⑤、⑥的原子半徑由大到小的順序為___(用元素符號表示)。
(2)元素③、⑦的最高價含氧酸的酸性由強到弱的順序為__。(用化學式表示)
(3)堿性強弱比較:元素⑤的氫氧化物__⑥的氫氧化物(用<、=、>填空);兩者相互反應的離子方程式為__。
(4)由元素⑤和⑧共同組成的化合物的電子式為__、它屬于__化合物。(填“共價”或“離子”)
(5)由元素①⑧形成的化合物A和由元素④⑤⑧的化合物B,可相互反應產生黃綠色氣體單質,該反應的離子方程式為__;該黃綠色氣體單質會使得濕潤淀粉碘化鉀試紙變藍色,表明生成了碘單質(I2),由此推測這兩種元的氣態氫化物的穩定性強弱順序為:__。(用化學式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對甲基苯乙烯(![]() )是有機合成的重要原料。下列對其結構與性質的推錯誤的是( )
)是有機合成的重要原料。下列對其結構與性質的推錯誤的是( )
A. 分子式為![]()
B. 能發生加聚反應和氧化反應
C. 具有相同官能團的芳香烴同分異構體有5種![]() 不考慮立體異構
不考慮立體異構![]()
D. 分子中所有原子可能處于同一平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】端炔烴在催化劑存在下可發生偶聯反應,稱為Glaser反應。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 該反應在研究新型發光材料、超分子化學等方面具有重要價值。下面是利用Glaser反應制備化合物E的一種合成路線:
R-C≡C-C≡C-R+H2, 該反應在研究新型發光材料、超分子化學等方面具有重要價值。下面是利用Glaser反應制備化合物E的一種合成路線:

回答下列問題:
(1)B的結構簡式為________,D的化學名稱為________。
(2)①和③的反應類型分別為________、________。
(3)E的結構簡式為______。用1 mol E合成1,4二苯基丁烷,理論上需要消耗氫氣__ mol。
(4)化合物(![]() )也可發生Glaser偶聯反應生成聚合物,該聚合反應的化學方程式為__________。
)也可發生Glaser偶聯反應生成聚合物,該聚合反應的化學方程式為__________。
(5)芳香化合物F是C的同分異構體,其分子中只有兩種不同化學環境的氫,數目比為3∶1,寫出其中3種的結構簡式_____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A. Ca(CH3COO)2溶液與硫酸反應:Ca2++SO42-=CaSO4↓
B. Cl2與熱的NaOH溶液反應:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
C. 電解K2MnO4堿性溶液制KMnO4:2MnO42-+2H+![]() 2MnO4-+H2↑
2MnO4-+H2↑
D. NaHCO3與過量Ba(OH)2溶液反應:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鎵有“電子工業脊梁”的美譽,鎵及其化合物應用廣泛。
(1)基態Ga原子中有_____種能量不同的電子,其價電子排布式為_________。
(2)第四周期的主族元素中,基態原子未成對電子數與鎵相同的元素有_______(填元素符號)。
(3)三甲基鎵[(CH3)3Ga]是制備有機鎵化合物的中間體。
①在700℃時,(CH3)3Ga和AsH3反應得到GaAs,化學方程式為____________________。
②(CH3)3Ga中Ga原子的雜化方式為__________;AsH3的空間構型是________________。
(4)GaF3的熔點為1000℃,GaC13的熔點為77.9℃,其原因是_______________________。
(5)砷化鎵是半導體材料,其晶胞結構如圖所示。
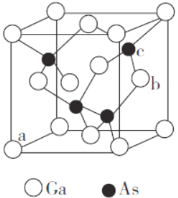
①晶胞中與Ga原子等距離且最近的As原子形成的空間構型為_______。
②原子坐標參數是晶胞的基本要素之一,表示晶胞內部各原子的相對位置。圖中a(0,0,0)、b(1,![]() ),則c原子的坐標參數為______________。
),則c原子的坐標參數為______________。
③砷化鎵的摩爾質量為M g·mol-1,Ga的原子半徑為p nm,則晶體的密度為____g·cm-3。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com