
【題目】氮元素可形成多種化合物,在工業生產中具有重要價值。 請回答下列問題:
(1)已知拆開1mol H-H 鍵,1mol N-H鍵, 1mol N≡N鍵分別需要的能量是436 kJ、391 kJ、946 kJ,且該反應為可逆反應,則N2與H2反應合成NH3的熱化學方程式為_________。
(2)一定溫度下,將一定量的N2和H2充入固定體積的密閉容器中進行合成氨反應,
①下列描述能說明該可逆反應達到化學平衡狀態的有___________
A.容器內氣體的密度不變 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.容器內的壓強不變 D.3v正(H2) =2v逆(NH3)
E. 容器內氣體的平均相對分子質量不變
F. 相同時間內有3molH-H鍵斷裂,有6mol N-H鍵形成
②恒溫恒壓條件下,為提高合成氨反應中N2和H2的利用率,可以采用的方法有________________。
(3)一定溫度下,2L密閉容器中充入0.40 mol N2O4,發生反應:N2O4(g)![]() 2NO2(g),一段時間后達到平衡,測得數據如下:
2NO2(g),一段時間后達到平衡,測得數據如下:
時間/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s內,v(NO2)=___________,該溫度下反應的化學平衡常數數值為_________。
②升高溫度時,氣體顏色加深,則正反應是_________(填“放熱”或“吸熱”)反應。
③相同溫度下,若開始向該容器中充入0.40 mol NO2,則達到平衡后: c(NO2)_____0.15 mol·L-1(填“>”、 “=”或“<”)
【答案】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1CE及時將NH3冷卻液化分離出去,及時將氮氣和氫氣進行循環利用0.006 mol·L-1·s-11.8吸熱>
2NH3(g) ΔH=-92 kJ·mol-1CE及時將NH3冷卻液化分離出去,及時將氮氣和氫氣進行循環利用0.006 mol·L-1·s-11.8吸熱>
【解析】
(1)在反應N2+3H22NH3中,斷裂3molH-H鍵、1molN≡N鍵共吸收的能量為:3×436kJ+946kJ=2254kJ,生成2molNH3時共形成6molN-H鍵,放出的能量為:6×391kJ=2346kJ,吸收的能量少,放出的能量多,該反應為放熱反應,放出的熱量=2346kJ-2254kJ=92kJ,則N2與H2反應生成NH3的熱化學方程式為:N2(g)+3H2(g)2NH3(g)△H=-92kJmol-1,故答案為:N2(g)+3H2(g)2NH3(g)△H=-92kJmol-1;
(2)①A.該反應中混合氣體質量、容器容積為定值,則混合氣體的密度始終不變,不能根據混合氣體的密度判斷平衡狀態,故A錯誤;B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2,無法判斷各組分的濃度是否繼續變化,則無法判斷平衡狀態,故B錯誤;C.該反應為氣體體積縮小的反應,壓強為變量,當容器內的壓強不變,表明正逆反應速率相等,該反應達到平衡狀態,故C正確;D.反應處于平衡時,2v正(H2)=3v逆(NH3),故D錯誤;E. 該反應是氣體的物質的量減小的反應,氣體的物質的量為變量,根據![]() =
=![]() ,容器內氣體的平均相對分子質量不變,說明氣體的總物質的量不變,能夠說明達到平衡狀態,故E正確;F.相同時間內有 3molH-H 鍵斷裂,有 6molN-H 鍵形成,表示的都是正反應速率,無法判斷正逆反應速率是否相等,故F錯誤;故答案為:C E;
,容器內氣體的平均相對分子質量不變,說明氣體的總物質的量不變,能夠說明達到平衡狀態,故E正確;F.相同時間內有 3molH-H 鍵斷裂,有 6molN-H 鍵形成,表示的都是正反應速率,無法判斷正逆反應速率是否相等,故F錯誤;故答案為:C E;
② 恒溫恒壓條件下,為提高合成氨反應中N2和H2的利用率,須平衡向著正反應方向移動,可以采用的方法有及時將NH3冷卻液化分離出去,及時將氮氣和氫氣進行循環利用等,故答案為:及時將NH3冷卻液化分離出去,及時將氮氣和氫氣進行循環利用;
(3)①20s時NO2的濃度為0.12mol/L,則20s內用二氧化氮表示的平均反應速率v(NO2)=![]() =0.006molL-1s-1,起始時c(N2O4)=
=0.006molL-1s-1,起始時c(N2O4)=![]() =0.2mol/L,根據表格數據,平衡時c(NO2)=0.3mol/L,則c(N2O4)=0.2mol/L-0.15mol/L=0.05mol/L,化學平衡常數K=
=0.2mol/L,根據表格數據,平衡時c(NO2)=0.3mol/L,則c(N2O4)=0.2mol/L-0.15mol/L=0.05mol/L,化學平衡常數K=![]() =1.8,故答案為:0.006 molL-1s-1;1.8;
=1.8,故答案為:0.006 molL-1s-1;1.8;
②升高溫度時,氣體顏色加深,說明升溫后,平衡正向移動,則正反應為吸熱反應,故答案為:吸熱;
③相同溫度下,若開始向該容器中充入0.40 mol NO2,相當于開始向該容器中充入0.20 mol N2O4,由于容器體積不變,則相當于減小壓強,平衡正向移動,因此則達到平衡后: c(NO2)大于原來的一半,即c(NO2)>0.15 mol·L-1,故答案為:>。


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案科目:高中化學 來源: 題型:
【題目】有關堿金屬性質的敘述錯誤的是( )
A.隨核電荷數的增加,堿金屬的熔、沸點降低
B.隨核電荷數的增加,堿金屬的密度增大
C.鋰在氧氣中燃燒生成過氧化鋰
D.堿金屬與水反應生成堿和氫氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一容積不變的密閉容器中充入一定量A和B,發生如下反應:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定條件下,容器中A、C的物質的量濃度隨時間變化的曲線如圖所示。請回答下列問題:
yC(g) ΔH<0,一定條件下,容器中A、C的物質的量濃度隨時間變化的曲線如圖所示。請回答下列問題:

(1)用A的濃度變化表示該反應在0~10 min內的平均反應速率v(A)=______________________。
(2)根據圖示可確定x∶y=________。
(3)0~10 min容器內壓強________(填“變大”、“不變”或“變小”)。
(4)推測第10 min引起曲線變化的反應條件可能是______________________;第16min引起曲線變化的反應條件可能是________________________。
①減壓 ②增大A的濃度 ③增大C的量 ④升溫⑤降溫 ⑥加催化劑
(5)若平衡Ⅰ的平衡常數為K1,平衡Ⅱ平衡常數為K2,則K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼是第IIIA族元素,單質硼在加熱條件下能與多種非金屬反應。某同學欲利用氯氣和單質硼反應制備三氯化硼。已知BC13的沸點為12.5 ℃ ,熔點為-107.3 ℃,遇水劇烈反應,生成硼酸和鹽酸。該同學選用下圖所示的部分裝置(可以重復選用)進行實驗,請回答下列問題:
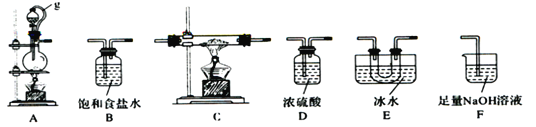
(1)A中反應的離子方程式為__________________。
(2)圖中g管的作用是______________________________________。
(3)裝置的連接順序依次為A→ → → →E→D→F;____________在E、F裝置間連接D裝置的作用是____________________________________________________________。
(4)停止實驗時,正確的實驗操作是______________________________________________________________________________________________________________。
(5)若硼酸(H3BO3)為一元弱酸,則其鈉鹽NaH2BO3為_____(填“正鹽”或“酸式鹽”或“堿式鹽”)。
(6)實驗完成后,某同學向F中(溶液含有0.05mol/LNaC1O、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品紅溶液,發現溶液褪色。現設計實驗探究溶液褪色的原因,請在表中空格處填上數據,完成實驗方案。
實驗序號 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品紅 溶液 | 現象 |
① | 5.0 | 0 | 0 | x | 4滴 | 較快褪色 |
② | 0 | 5.0 | 5.0 | 0 | 4滴 | 不褪色 |
③ | 5.0 | 0 | 5.0 | 0 | 4滴 | 緩慢褪色 |
則x=_______,結論:________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學氣敏傳感器可用于檢測環境中NH3的含量,其工作原理示意圖如下。

下列說法不正確的是
A. O2在電極b上發生還原反應
B. 溶液中OH+向電極a移動
C. 負極的電極反應式為:2NH3-6e-+6OH-=N2+6H2O
D. 反應消耗的NH3與O2的物質的量之比為4:5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.01mol氯化鉻(CrCl3·6H2O)在水溶液中用過量的AgNO3處理,產生0.01mol AgCl沉淀,此氯化鉻最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,摻入少量Ti的NaAlH4在150℃時釋氫,在170℃、15.2MPa條件下又重復吸氫。NaAlH4可由AlCl3和NaH在適當條件下合成。NaAlH4的晶胞結構如圖所示。

(1)基態Ti原子的價電子軌道表示式為_______。
(2)AlH4-的空間構型為_______________,中心原子Al的軌道雜化方式為________;
(3)AlCl3在178℃時升華,其蒸氣的相對分子質量約為267,蒸氣分子的結構式為________________(標明配位鍵)。
(4)NaH的熔點為800℃,不溶于有機溶劑NaH屬于____晶體,其電子式為_____________。
(5)NaAlH4晶體中,與Na+緊鄰且等距的AlH4-有_____個;NaAlH4晶體的密度為________g·cm-3(用含a的代數式表示)。若NaAlH4晶胞底心處的Na+被Li+取代,得到的晶體為__________(填化學式)。
(6)NaAlH4的釋氫機理為:每3個AlH4-中,有2個分別釋放出3個H原子和1個Al原子,同時與該Al原子最近鄰的Na原子轉移到被釋放的Al原子留下的空位,形成新的結構。這種結構變化由表面層擴展到整個晶體,從而釋放出氫氣。該釋氫過程可用化學方程式表示為____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
第四周期的過渡元素在工業、農業、科學技術以及人類生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的電熱元件材料。請回答:
(1) 基態Ni原子核外電子排布式為________;第二周期中基態原子未成對電子數與Ni相同且電負性大的元素為________ 。
(2) 金屬Ni粉在CO氣流中輕微加熱,生成無色揮發性液態Ni(CO)4,該分子呈正四面體構型。試推斷Ni(CO)4的晶體類型為_____,Ni(CO)4 易 溶于下列_____ (填選項字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸鎳溶液
(3) FeO、NiO 晶體中r(Ni2+)和r(Fe2+)分別為69pm 和78pm,則熔點NiO__FeO(填“>"或“<”),原因為_________ 。
(4) 黃血鹽是一種配合物,其化學式為K4[Fe(CN)6]·3H2O,該配合物中配體的化學式為_________,黃血鹽溶液與稀硫酸加熱時發生非氧化還原反應,生成硫酸鹽和一種與該配體互為等電子體的氣態化合物,該反應的化學方程式為_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,鄰硝基苯酚和對硝基苯酚在20℃水中的溶解度之比為0.39,其原因為________。
(6) 在鉻的硅酸鹽中,SiO44-四面體如下圖(a)通過共用頂角氧離子可形成島狀、鏈狀、層狀、骨架網狀四大結構型式。圖(b)為一種鏈狀結構的多硅酸根,其中硅原子的雜化形式為_______,其化學式為________。
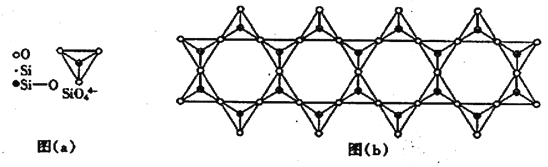
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com