
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-4c}{a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{b-4c}{a}$ |
分析 bmolNaOH恰好把NH3全部趕出,根據NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,另一份與氯化鋇溶液完全反應消耗cmolBaCl2,根據Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol;根據溶液不顯電性,計算出每份中NO3-的物質的量,再根據c=$\frac{n}{V}$計算.
解答 解:bmolNaOH恰好把NH3全部趕出,根據NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
另一份與氯化鋇溶液完全反應消耗cmolBaCl2,根據Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol,
設每份中NO3-的物質的量為n,根據溶液不顯電性,
則:bmol×1=cmol×2+n×1,
解得:n=(b-2c)mol,
每份溶液的體積為0.5aL,所以每份溶液硝酸根的濃度為:c(NO3-)=$\frac{(b-2c)mol}{0.5aL}$=$\frac{2b-4c}{a}$mol/L,
溶液具有均一性,則原溶液中硝酸根的濃度為$\frac{2b-4c}{a}$mol/L,
故選B.
點評 本題考查混合物反應的計算,題目難度中等,明確發(fā)生反應的實質為解答關鍵,注意掌握守恒思想在化學計算中的應用方法,試題培養(yǎng)了學生的分析能力及化學計算能力


科目:高中化學 來源: 題型:解答題

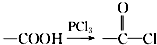 ,請回答以下問題:
,請回答以下問題: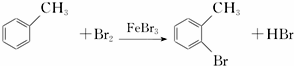 .
.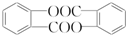 .
.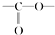 結構
結構查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應②中除掉的雜質離子是Fe2+和Mn2+ | |
| B. | 步驟②加高錳酸鉀前若PH較低則Fe2+和Mn2+不能除去 | |
| C. | 反應③的類型為置換反應,濾渣中含有鋅和鎳 | |
| D. | 反應④中的產物成分可能是ZnCO3.xZn(OH)2若得到干燥濾餅22.4克,煅燒后可得到產品16.2克,則X=2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 已知:常溫下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其鈉鹽的溶液中,H2R、HR-、R2-分別在三者中所占的物質的量分數(α)隨溶液pH變化關系如圖所示,下列敘述錯誤的是( )
已知:常溫下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其鈉鹽的溶液中,H2R、HR-、R2-分別在三者中所占的物質的量分數(α)隨溶液pH變化關系如圖所示,下列敘述錯誤的是( )| A. | 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等體積等濃度的NaOH溶液與H2R溶液混合后,溶液中水的電離程度比純水小 | |
| C. | 在pH=3的溶液中存在$\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})}$=10-3 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,發(fā)生反應:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 構成單質的分子中一定含有共價鍵 | |
| B. | 由非金屬元素組成的化合物可能是離子化合物 | |
| C. | 非極性鍵只存在單質分子里 | |
| D. | 不同元素組成的多原子分子里的化學鍵一定是極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 置換反應一定都是氧化還原反應 | |
| B. | 化合反應不一定都是氧化還原反應 | |
| C. | 復分解反應一定都不是氧化還原反應 | |
| D. | 氧化還原反應都是置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 稀硫酸與氫氧化鋇溶液反應 H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 硫酸鋁溶液中滴入氨水 Al3++3OH-=Al(OH)3↓ | |
| C. | 碳酸氫鎂溶液中加入過量氫氧化鈉溶液 Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O | |
| D. | 硝酸鋁溶液中滴加少量的氫氧化鈉溶液 Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體和溶液的本質區(qū)別是分散質粒子直徑的大小 | |
| B. | 電解質與非電解質的本質區(qū)別,是在水溶液或熔融狀態(tài)下中能否電離 | |
| C. | 科學家波爾首先提出原子核外的電子是在一定軌道上運動 | |
| D. | 具有相同質子數的微粒,一定屬于同一種元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中只能含離子鍵 | B. | 共價化合物中可能含離子鍵 | ||
| C. | 共價鍵只存在于共價化合物中 | D. | 離子鍵只存在于離子化合物中 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com