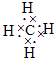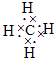解答:解:(1)X原子在第二能層上只有一個空軌道,則X能層的2p能級含有一個空軌道,則X核外電子數是6,為C元素,根據構造原理知其核外電子排布式1S
22S
22P
2;
R原子的3p軌道上只有一個未成對電子,則價層電子排布式為3s
23p
1或3s
23p
5,則R原子3p軌道上可能含有1個電子或5個電子,則R可能是Al或Cl元素;
故答案為:C;1S
22S
22P
2;Al或Cl;
(2)根據配合物K
3[Co(CN)
6]結構分析,含有空軌道的金屬陽離子為中心離子,所以中心離子為Co
3+、有孤對電子的原子或離子為配體,所以配體為CN
-、配位數就是配體的個數,所以配位數為6,
故答案為:Co
3+、CN
-、6;
(3)手性碳原子指連有四個不同基團的碳原子,所以

圖中標“*”連有四個不一樣的基團:氫原子、甲基、羥基以及羧基,為手性碳原子,
故答案為:

;
(4)①CO
2中C元素化合價為+4,C原子最外層4個電子全部成鍵,為非極性分子;
②NH
3中C元素化合價為-3,N原子最外層5個電子未全部成鍵,為極性分子;
③CCl
4中C元素化合價為+4,C原子最外層4個電子全部成鍵,為非極性分子;
④BF
3中B元素化合價為+3,B原子最外層3個電子全部成鍵,為非極性分子;
⑤H
2O中O元素化合價為-2,O原子最外層6個電子未全部成鍵,為極性分子;
⑥SO
2中S元素化合價為+4,S原子最外層6個電子未全部成鍵,為極性分子;
⑦SO
3中S元素化合價為+6,S原子最外層6個電子全部成鍵,為非極性分子;
⑧PCl
3中P元素化合價為+3,P原子最外層5個電子未全部成鍵,為極性分子;
故選①③④⑦;
(5)H
2O中心原子O原子成2個σ鍵、含有2對孤對電子,故雜化軌道數為4,采取sp
3雜化,故空間結構為V形;
BF
3分子中,中心B原子成3個σ鍵、沒有孤對電子,故雜化軌道數為3,采取sp
2雜化,故空間結構為平面正三角形;
C
2H
4中C共價雙鍵中含有一個σ鍵一個π鍵,形成3個σ鍵,無孤電子對,為sp
2雜化,空間結構為矩形四角頂點為氫原子六個原子共平面,所以為平面形;
C
2H
2分子中碳原子形成1個C-H,1個C≡C三鍵,C原子雜化軌道數為(1+1)=2,采取 sp雜化方式,空間結構為直線形;
故答案為:sp
3;V形;sp
2;平面正三角形;sp
2;平面形;sp;直線形;
(6)水分子之間存在氫鍵,沸點高于同族其它元素氫化物,
故答案為:水分子之間存在氫鍵;


 圖中標“*”連有四個不一樣的基團:氫原子、甲基、羥基以及羧基,為手性碳原子,
圖中標“*”連有四個不一樣的基團:氫原子、甲基、羥基以及羧基,為手性碳原子, ;
;

 世紀百通主體課堂小學課時同步達標系列答案
世紀百通主體課堂小學課時同步達標系列答案 世紀百通優練測系列答案
世紀百通優練測系列答案 百分學生作業本題練王系列答案
百分學生作業本題練王系列答案