
工業燃燒煤、石油等化石燃料釋放出大量氮氧化物(NOx)、CO2、SO2等氣體,嚴重污染空氣。對廢氣進行脫硝、脫碳和脫硫處理可實現綠色環保、廢物利用。
Ⅰ.脫硝:已知:H2的熱值為142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化劑存在下,H2還原NO2生成水蒸氣和其它無毒物質的熱化學方程式為 。
Ⅱ.脫碳:向2L密閉容器中加入2mol CO2、6mol H2,在適當的催化劑作用下,發生反應:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①該反應自發進行的條件是 (填“低溫”、“高溫”或“任意溫度”)
②下列敘述能說明此反應達到平衡狀態的是 。
a、混合氣體的平均式量保持不變
b、CO2和H2的體積分數保持不變
c、CO2和H2的轉化率相等
d、混合氣體的密度保持不變
e、1mol CO2生成的同時有3mol H-H鍵斷裂
③CO2的濃度隨時間(0~t2)變化如下圖所示,在t2時將容器容積縮小一倍,t3時達到平衡,t4時降低溫度,t5時達到平衡,請畫出t2~t6 CO2的濃度隨時間的變化。
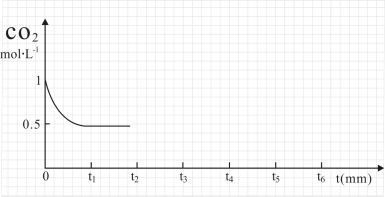
(2)改變溫度,使反應CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0 中的所有物質都為氣態。起始溫度體積相同(T1℃、2 L密閉容器)。反應過程中部分數據見下表:
CH3OH(g)+H2O(g) △H<0 中的所有物質都為氣態。起始溫度體積相同(T1℃、2 L密閉容器)。反應過程中部分數據見下表:
反應時間 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反應I 恒溫恒容 | 0 min | 2 | 6[ | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反應II 絕熱恒容 | 0 min | 0 | 0 | 2 | 2 |
①達到平衡時,反應I、II對比:平衡常數K(I) K(II)(填“>”、“<”或“=”下同);平衡時CH3OH的濃度c(I) c(II)。
②對反應I,前10min內的平均反應速率v(CH3OH)= ,在其它條件不變下,若30min時只改變溫度為T2℃,此時H2的物質的量為3.2mol,則T1 T2(填“>”、“<”或“=”)。
若30min時只向容器中再充入1 mol CO2(g)和1 mol H2O(g),則平衡 移動(填“正向”、“逆向”或“不”)。
 步步高口算題卡系列答案
步步高口算題卡系列答案 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源:2015-2016學年湖北省高二5月月考化學試卷(解析版) 題型:填空題
I.下表為周期表的一部分,其中的編號代表對應的元素。

(1)寫出上表中元素I的價層電子排布圖 。元素C、D、E、F的第一電離能由大到小的順序是 (用元素符號表示)。
(2)元素A分別與C、D、E形成最簡單的常見化合物分子甲、乙和丙。下列有關敘述不正確的有( )
A.甲、乙和丙分子的空間構型分別為正四面體形、三角錐形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的雜化方式
C.三種分子中鍵角由大到小的順序是丙>乙>甲
D.甲、乙和丙分子均為由極性鍵構成的極性分子
(3)由元素J、C、E組成一種化學式為J(CE)的配位化合物,該物質常溫下呈液態,熔點為一20.5℃,沸點為103℃,易溶于非極性溶劑。據此可判斷:該化合物的晶體中存在的作用力有( )
A.離子鍵
B.極性鍵
C.非極性鍵
D.范德華力
E.氫鍵
F.配位鍵
Ⅱ.(1) BCl3中B原子的雜化方式為 。第一電離能介于B、N之間的第二周期元素有 種。寫出與BCl3結構相同的一種等電子體 (寫離子)。
(2)科學家測得膽礬中既含有配位鍵,又含有氫鍵,其結構示意圖可簡單表示如下:
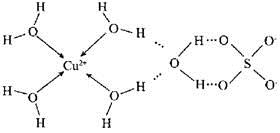
①膽礬的化學式用配合物的形式表示為的 ;
②膽礬中SO42-的空間構型為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高二下學期第二次月考化學試卷(解析版) 題型:選擇題
下列物質性質與應用不存在對應關系的是
A.K2FeO4具有強氧化性,可用作水處理劑
B.氫氧化鋁具有弱堿性,可用作制胃酸中和劑
C.碳具有還原性,可用作鋅錳干電池的正極材料
D.常溫下濃硫酸能使鋁發生鈍化,可用鋁制容器貯運濃硫酸
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省高一下第三次月考化學試卷(解析版) 題型:選擇題
下列各數值表示有關元素的原子序數,其中能以共價鍵相互結合形成穩定化合物的是( )
A.2和19 B.6與8 C.8與11 D. 9與9
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省高一下第三次月考化學試卷(解析版) 題型:選擇題
下列化學用語正確的是( )
A.核內有8個中子的碳原子: C
C
B.氯離子的結構示意圖:
C. HCl的電子式:
D.甲烷分子的比例模型:
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二下學期期中考試化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數,下列說法正確的是
A.4.6 g NO2與N2O4的混合氣體中所含氮原子數為0.1NA
B.常溫常壓下1.6 g甲烷所含共用電子對數為0.1NA
C.標準狀況下,6.72 L CO2與足量Na2O2反應轉移電子數為0.6NA
D.50 mL 98%濃硫酸(密度為1.84 g•cm-3)與足量銅共熱,轉移的電子數為 0.92NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二下學期期中考試化學試卷(解析版) 題型:選擇題
下列各組順序的排列不正確的是
A. 離子半徑:Na+>Mg2+>Al3+>F—
B. 熱穩定性:HCl>H2S>PH3
C. 酸性強弱:Al(OH)3<H2SiO3<H2CO3<H3PO4
D. 熔點:SiO2>NaCl>Na>CO2
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二下學期期中考試化學試卷(解析版) 題型:選擇題
下列反應的離子方程式正確的是
A.鈉與水反應 Na + H+ =Na+ + H2
B.用碳酸氫鈉作為抗酸藥來中和胃酸 H+ + HCO3— = H2O + CO2↑
C.用熟石灰來中和酸性廢水 Ca(OH)2 + H+ = Ca2+ + 2H2O
D.用H2SO4來中和堿性廢水 2H+ + 2OH— = H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二6月月考化學試卷(解析版) 題型:選擇題
“類比法”是化學學習中的一種常用方法。下列說法正確的是 ( )
A.二氧化碳能使漂白粉水溶液先變渾濁后變澄清,二氧化硫也有同樣現象
B.加熱條件下,鈉與氧氣反應生成過氧化鈉,鋰與氧氣反應也生成過氧化鋰
C.常溫下,濃硝酸能使鐵、鋁鈍化,濃硫酸也能使鐵、鋁鈍化
D.鐵可置換出硫酸銅溶液中的銅,鈉也可置換出硫酸銅溶液中的銅
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com