
| 容器編號 | 起始時各物質物質的量/mol | 達平衡過程體系 能量的變化 | ||||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | 放出熱量:32.8kJ | |
| A. | 容器①中反應達平衡時,CO的轉化率為80% | |
| B. | 平衡時,兩容器中CO2的濃度相等 | |
| C. | 容器①中CO的轉化率等于容器②中CO2的轉化率 | |
| D. | 容器①中CO反應速率等于H2O(g)的反應速率 |
分析 A.根據平衡時放出的熱量,結合熱化學方程式計算參加反應的CO的物質的量,再根據轉化率定義計算;
B.容器①②溫度相同,同一可逆反應正逆平衡常數互為倒數,根據容器①計算平衡常數,令容器②中CO2的物質的量變化量為amol,表示出平衡時各組分的物質的量,反應前后氣體的體積不變,利用物質的量代替濃度代入平衡常數表達式計算a的值,進而計算CO2的濃度,
C.根據B中的計算判斷;
D.速率之比等于化學計量數之比.
解答 解:A.平衡時放出的熱量為32.8 kJ,故參加反應的CO的物質的量$\frac{32.8\;kJ}{41kJ}$×1mol=0.8mol,CO的轉化率為$\frac{0.8mol}{1mol}$×100%=80%,故A正確;
B.容器①②溫度相同,平衡常數相同,根據容器①計算平衡常數,由A計算可知,平衡時CO的物質的量變化量為0.8mol,
則:CO(g)+H2O(g)?CO2(g)+H2(g)
開始(mol):1 4 0 0
變化(mol):0.8 0.8 0.8 0.8
平衡(mol):0.2 3.2 0.8 0.8
故平衡常數K=$\frac{0.8×0.8}{0.2×3.2}$=1,
故容器②中的平衡常數為1,令容器②中CO2的物質的量變化量為amol,則:
CO2(g)+H2(g)?CO(g)+H2O(g)
開始(mol):1 4 0 0
變化(mol):a a a a
平衡(mol):1-a 4-a a a
所以$\frac{a×a}{(1-a)×(4-a)}$,解得a=0.8,
由A中計算可知容器①平衡時CO2的物質的量為0.8mol,容器②中CO2的物質的量為1mol-0.8mol=0.2mol,容器的體積相同,平衡時,兩容器中CO2的濃度不相等,故B錯誤;
C.→B計算可知CO2的轉化率為$\frac{0.8mol}{1mol}$×100%=80%,故C正確;
D.速率之比等于化學計量數之比,故容器①中CO反應速率等于H2O的反應速率,故D正確;
故選B.
點評 本題考查化學平衡的計算,為高考常見題型,題目難度中等,平衡判斷和平衡常數的計算是解題關鍵,有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH溶液中滴入CuSO4溶液 OH-+Cu2+=Cu(OH)2↓ | |
| B. | 乙醛發生銀鏡反應CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4+2Ag↓+3NH3+H2O | |
| C. | 醋酸與碳酸鈉溶液反應 CO32-+2H+=H2O+CO2↑ | |
| D. | 溴乙烷中滴入AgNO3溶液 Ag++Br-=AgBr↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | 雜質 | 試劑 | 方法 | |
| A | 氯化鐵溶液 | 氯化亞鐵 | 過量鐵粉 | 過濾 |
| B | 二氧化碳 | 二氧化硫 | 飽和NaHCO3溶液 | 洗氣 |
| C | 二氧化硅 | 氧化鋁 | 氨水 | 過濾 |
| D | 氯化鈉溶液 | 碘化鈉 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 已知乙醇可以和氯化鈣反應生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化鈣反應生成微溶于水的CaCl2•6C2H5OH.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
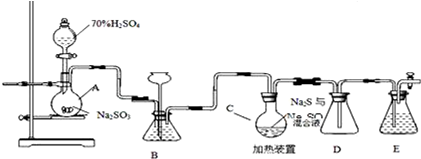
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
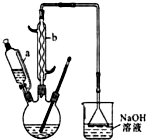 己二酸
己二酸 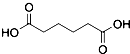 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖: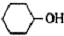 +8HNO3→3
+8HNO3→3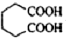 +8NO↑+7H2O
+8NO↑+7H2O| 物資 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
| 環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時1.44g,25℃時2.3g,易溶于乙醇,不溶于苯. | 146 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com