
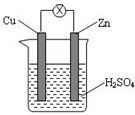
| A. | Zn 是負極,發生還原反應 | B. | Cu 是負極,發生氧化反應 | ||
| C. | Cu 片上有氣體逸出 | D. | 電子由 Cu 片通過導線流向 Zn 片 |
分析 該裝置是將化學能轉化為電能的裝置,為原電池,Zn易失電子作負極、Cu作正極,電子從負極沿導線流向正極,據此分析解答.
解答 解:A.該裝置是原電池,Zn易失電子發生氧化反應而作負極、Cu作正極,故A錯誤;
B.Cu作正極,發生還原反應,故B錯誤;
C.銅是正極,氫離子在正極得電子發生還原反應:2H++2e-=H2↑,故C正確;
D.負極上失電子、正極上得電子,該裝置中Zn是負極、Cu是正極,所以電子從Zn沿導線流向正極Cu,故D錯誤;
故選C.
點評 本題考查原電池原理,為高頻考點,明確原電池概念、正負極判斷、電子流向是解本題關鍵,注意電解質溶液中陰陽離子移動方向,電子不進入電解質溶液,為易錯點.


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A>B>C>D | B. | C>A>D>B | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
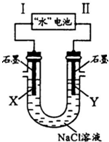 研究人員發現了一種“水”電池,其總反應為:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如圖用“水”電池為電源電解NaCl溶液的實驗中,X電極上有無色氣體逸出.下列有關分析正確的是( )
研究人員發現了一種“水”電池,其總反應為:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl.如圖用“水”電池為電源電解NaCl溶液的實驗中,X電極上有無色氣體逸出.下列有關分析正確的是( )| A. | I為負極,其電極反應式為Ag+Cl-+e-=AgCl | |
| B. | “水”電池內Na+不斷向負極作定向移動 | |
| C. | 每轉移1 mol e-,U型管中消耗0.5 mol H2O | |
| D. | “水”電池內,每生成1 mol Na2Mn5O10,X電極上生成1 mol氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com